
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。
【答案】 蒸馏烧瓶 c 偏低 滴加最后一滴碘标准溶液后。溶液颜色变蓝,且30s内不褪色 SO2+I2+2H2O=4H++SO42-+2I-(或H2SO4+I2+H2O=4H++SO42-+2I- ) 320 空白实验
【解析】(1)仪器A的名称是蒸馏烧瓶。
(2)由已知条件知A中加入物质的总体积为285ml,进行蒸馏,碘量瓶中的液体约200mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中,所以选择500 mL合适。答案:c。
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会有一小部分物质停留在导管中,会导致测定结果偏低。答案:偏低。
(4)因为碘遇淀粉变蓝,开始发生. SO2+I2+2H2O=4H++SO42-+2I-,当SO2反应完全后,再滴溶液就会变蓝色,所以达到滴定终点的现象是滴加最后一滴碘标准溶液后。溶液颜色变蓝,且30s内不褪色,该滴定反应的离子方程式是SO2+I2+2H2O=4H++SO42-+2I-。
(5)有反应 SO2 + I2 + 2H2O=4H++SO42-+2I-
1mol 1mol
0.01 X (9.98+10.02+10.00)/3000![]() 0.01mol·L-1
0.01mol·L-1
X=10-2mol
葡萄酒中SO2的含量为=10-2mo![]() l
l![]() 64g/mol=320mg·L-1 答案:320。
64g/mol=320mg·L-1 答案:320。


科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数Kb=1.6×10-4)。下列说法正确的是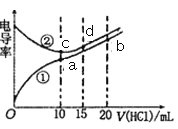
A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mL
B. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<b
C. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少
D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A.0.1mol/L的盐酸15mL
B.0.2mol/L的盐酸12mL
C.0.25mol/L的盐酸8mL
D.18mol/L的硫酸15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外兴趣小组的同学欲测定某品牌味精中食盐的含量。下面是该小组所进行的实验步骤:
①称取某品牌袋装味精样品10.0 g放入烧杯中,并加适量蒸馏水溶解;
②______________________________________;
③______________________________________;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得固体质量4.90 g。
根据上述实验步骤回答下列问题:
(1)请你在上面的空格内补齐所缺的实验步骤②、③。
(2)实验③所用的玻璃仪器有____________。
(3)检验沉淀是否洗净的方法是________________。
(4)若味精商标上标注:“谷氨酸钠含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃时在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示.下列说法正确的是__________________
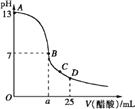
A.滴定终点时俯视读数则测定的氢氧化钠浓度偏高
B.B、C、D三点的溶液中水的电离程度为B>C>D
C.D点,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B点为滴定终点
E.B点时c(CH3COO-)=c(Na+)
F. 若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)< c(CH3COOH)
G.滴定前的氢氧化钠溶液的浓度为0.1mol/L
Ⅱ.(1)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________
(2)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种元素 A、B、C、D,其中 B2-离子与 C+离子核外都有二个电子层,B 原子的质子数与 C 原子的 质子数之和等于 D 原子的质子数,A 原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D 的元素符号分别为____、____、____、____。
(2)B2-的电子式 ________,D 原子的原子结构示意图为____,B 与 C 形成的简单化合物的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体和非晶体,下列说法中正确的( )
A. 铁是非晶体
B. 晶体和非晶体在熔化过程中温度都上升
C. 晶体熔化时吸热,非晶体熔化时不吸热
D. 晶体有固定熔点,非晶体没有固定熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com