
| 2.8L |
| 22.4L/mol |
 ��
�� ��
��| 2.8L |
| 22.4L/mol |
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
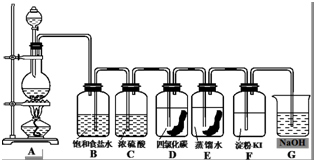
| A�����ˡ���������ȡ������ |
| B��������ȡ����Һ������ |
| C����ȡ�����ˡ���Һ������ |
| D�����ˡ�������ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Һ����ɫ |
| B��������Һ����ɫ |
| C���ϲ㼸����ɫ���²��Ϻ�ɫ |
| D���²㼸����ɫ���ϲ��Ϻ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
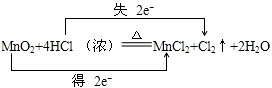
A��CH2=CH2+HCl
| |||
B��2CH3CHO+O2
| |||
C��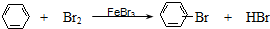 | |||
D��CH3CH2Br+NaOH
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
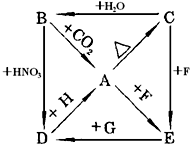 A��B��C��D��E�������ʶ��Ǻ����۽���Ԫ��X�Ļ��������֮���������ת����ϵ��ͼ��H��G��FΪ���ӵ��Լ����������Ϲ�ϵ�ش�
A��B��C��D��E�������ʶ��Ǻ����۽���Ԫ��X�Ļ��������֮���������ת����ϵ��ͼ��H��G��FΪ���ӵ��Լ����������Ϲ�ϵ�ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3.4gNH3�����ۼ�����ĿԼΪ0.2��6.02��1023�� |
| B��6.4g CuͶ��300 mL 10mol/L��Ũ�����У���ַ�Ӧ��ת��0.2��6.02��1023������ |
| C����״���£�22.4 L SO2��11.2 L O2����ϳ�ַ�Ӧ���ɵ�6.02��1023��SO3���� |
| D��l L 0.5mol/L̼������Һ�к���0.5��6.02��1023��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ǿ˳��NH3��NF3��F2 |
| B������NF3��Ӧ����0.5mol NH3��������ת�Ƶ��ӵ���ĿΪ1.806��1024 |
| C��NF3�ڳ�ʪ�����з�Ӧ���������뱻��ԭ��Ԫ�ص����ʵ���֮��Ϊ2��1 |
| D��������NF3й©��������NaOH��ʯ��ˮ��Һ���ܵķ����ɼ�����Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ɫ��ͬ |
| B��������H2O��CO2��Ӧ |
| C��Na2O�ܱ�������Na2O2 |
| D�����ǵĹ�������ˮ�μӷ�̪��Һ��������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com