
【题目】下列有关实验装置及用途叙述完全正确的是

A. a装置检验消去反应后有丙烯生成
B. b装置检验酸性:盐酸>碳酸>苯酚
C. c装置用于实验室制取并收集乙烯
D. d装置用于实验室制硝基苯
【答案】D
【解析】
A.乙醇易挥发,结合乙醇的性质分析判断;
B.盐酸易挥发,根据盐酸与苯酚钠能否反应,结合实验目的分析判断;
C.制备乙烯需要测定反应液的温度170℃,据此判断;
D.苯与浓硝酸发生取代反应生成硝基苯,水浴加热控制温度50~60℃,据此判断。
A.乙醇易挥发,也能被高锰酸钾氧化,则应排除乙醇的干扰,再检验,故A错误;
B.盐酸易挥发,盐酸与苯酚钠反应,则不能比较碳酸、苯酚的酸性,应排除盐酸的干扰,故B错误;
C.制备乙烯测定反应液的温度170℃,则温度计的水银球应在液面下,故C错误;
D.苯与浓硝酸发生取代反应生成硝基苯,水浴加热控制温度50~60℃,则图中装置可制备,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如下图所示的实验方案:

已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化。请回答下列问题:
(1)操作①盛放药品可选用___________(填仪器名称)。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是:___________________________。
(3)进行操作②后,判断SO42-已除尽的方法是:______________________________。
(4)操作③的目的是:____________________________________________________。
(5)此设计方案是否严密___________(填“是”或“否”)理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述变化理论上计量结果正确的是( )
A. 标准状况下,用含空气和氨气体积各半的烧瓶进行喷泉实验,所得溶液的物质的量浓度约为![]()
B. 相同质量的两份铝,分别放入足量的![]() 和
和![]() 溶液中充分反应,消耗的
溶液中充分反应,消耗的![]() 和
和![]() 之比为1∶1
之比为1∶1
C. 将![]() 逐滴加入到
逐滴加入到![]() 溶液中,产生
溶液中,产生![]() 的体积约为
的体积约为![]() (标准状况下)
(标准状况下)
D. 向![]() 的
的![]() 溶液中通入足量的
溶液中通入足量的![]() 气体,生成
气体,生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是盛放浓硫酸试剂瓶标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol·L-1的稀硫酸。请回答下列问题:

(1)配制上述稀硫酸时,可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。还缺少的仪器有______________(写仪器名称);
(2)容量瓶上除有刻度线外还应标有____________,在使用前必须检查容量瓶是否____________。
(3)配制240 mL 1.0 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸,量取浓硫酸时应选用以下_____规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.稀释 F.摇匀 G.计算
其正确的操作顺序应是______________(填序号)。
(5)经过测定,某同学配制的稀硫酸浓度偏低,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁和玻璃棒后将洗涤液倒入废液缸
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥摇匀后发现溶液的凹液面低于刻度线,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol MnO2和100 mL 12 mol·L-1盐酸混合后缓缓加热,生成气体单质A,反应完全后向留下的溶液中加入足量AgNO3溶液 (不考虑盐酸的挥发) 。下列说法错误的是
A.在生成气体A的反应中,MnO2是氧化剂,盐酸是还原剂
B.气体单质A是氯气,它的体积是2.24L
C.生成AgCl沉淀的物质的量为1mol
D.整个反应过程被氧化的盐酸有0.4mol,并转移了0.2mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的原因之一。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低![]() ,
,![]() 及碳氧化合物的排放。以
及碳氧化合物的排放。以![]() 为例,已知:
为例,已知:
①![]()
②![]()
③![]()
④![]()
①②③④反应热效应之间的关系式为![]() ___;有利于提高④
___;有利于提高④![]() 转化率的反应条件是___。
转化率的反应条件是___。
(2)研究发现,将煤炭在![]() 的气氛下燃烧,能够降低燃煤时
的气氛下燃烧,能够降低燃煤时![]() 的排放,主要反应为:
的排放,主要反应为:![]() 。
。
①该反应的平衡常数表达式为____。
②在密闭容器中发生该反应时,![]() 随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的
随温度(T)和时间(t)的变化曲线如图1所示。据此判断该反应的![]() ___0(填“>”或“<”),在
___0(填“>”或“<”),在![]() 温度下,
温度下,![]() 内
内![]() 的平均反应速率
的平均反应速率![]() ___。
___。
③将![]() 和
和![]() 充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图2所示。第12min时改变的反应条件可能为___。
A.升高温度 B.加入![]() C.加催化剂 D.降低温度
C.加催化剂 D.降低温度


④将上述反应产生的![]() 与
与![]() 为原料合成尿素,能够实现节能减排:
为原料合成尿素,能够实现节能减排:
Ⅰ:![]() Ⅱ:
Ⅱ:![]()
将一定量的![]() 固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时
固体加入恒容密闭容器中,在300K下发生反应Ⅱ,到达平衡时![]() ,
,![]() 为
为![]() ,若反应温度不变,将体系的体积增加50%,一段时间后
,若反应温度不变,将体系的体积增加50%,一段时间后![]() 的取值范围是____(用含a的式子表示)。
的取值范围是____(用含a的式子表示)。
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。![]() 及
及![]() 均是性能优良的脱硫脱硝试剂。
均是性能优良的脱硫脱硝试剂。
①![]() 在酸性条件下稳定,在
在酸性条件下稳定,在![]() 溶液中可歧化为
溶液中可歧化为![]() 和
和![]() ,该反应的化学方程式为___。
,该反应的化学方程式为___。
②某研究小组用![]() 进行单独脱除
进行单独脱除![]() 实验时,测得
实验时,测得![]() 的脱除率随溶液
的脱除率随溶液![]() 变化如图所示。当
变化如图所示。当![]() 时,随
时,随![]() 的增大,
的增大,![]() 脱除率逐渐降低,其原因是____。
脱除率逐渐降低,其原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加徳罗常数的值,诺贝尔物理学奖获得者让·佩兰于 1909 年提出常数命名 为阿伏加德罗常量来纪念他,下列说法正确的是
①标准状况下,11.2 L 以任意比例混合的氮气和氧气所含的原子数为 NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③2 mol/L 的氯化镁溶液中含氯离子数目为 4 NA
④标准状况下,22.4 L 水中分子数为 NA
⑤46 g NO2 和 N2O4 混合气体中含有原子数为 3 NA
A.①②⑤B.①②C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)气体发生装置B产生的气体是________。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入________(选填一个序号)试剂,实验现象是_______________________________。
b.若SO2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,实验现象是________________________________________。
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
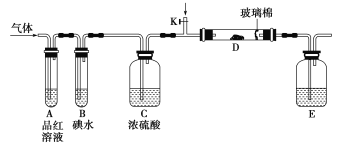
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为________________________________。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐中添加较多的是碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极材料,以KI溶液为电解液,在一定条件下进行电解,反应的化学方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是
A. 加碘食盐不能使淀粉溶液变蓝
B. 电解时,石墨作阳极,不锈钢作阴极
C. 阳极的电极反应式为I-+3H2O+6e-=IO3-+6H+
D. 转移3 mol电子,理论上可制得107 g KIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com