
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 | __________________ __________________ _________________。 | 乙同学的观点____________ (填“正确”或“错误”)。 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.仅用KSCN可以检验Fe2+ | B.可以用NaOH溶液检验Fe3+ |
| C.通过化合反应可以得到Fe(OH)3 | D.通过化合反应可以得到FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.烧杯中有铜无铁 |
| B.烧杯中有铁无铜 |
| C.烧杯中铁、铜都有 |
| D.烧杯中铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
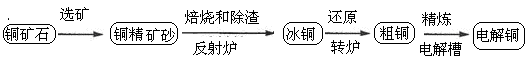
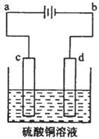
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此陨石是一种纯度较高的硅酸盐矿石 |
| B.此陨石具有耐酸碱的特性 |
| C.陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D.橄榄石中Fe为+2价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
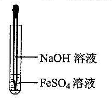
| A.氢氧化亚铁易被空气氧化 |
| B.氢氧化亚铁为灰绿色絮状沉淀 |
| C.可利用右图所示装置,制备氢氧化亚铁 |
| D.实验中所用氢氧化钠溶液应预先煮沸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com