


| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |

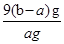 或
或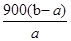 %(2分)
%(2分)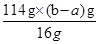 =9(b-a)g
=9(b-a)g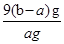 ×100%=
×100%=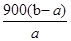 %
%

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:不详 题型:填空题
 6Cu+SO2
6Cu+SO2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 | __________________ __________________ _________________。 | 乙同学的观点____________ (填“正确”或“错误”)。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
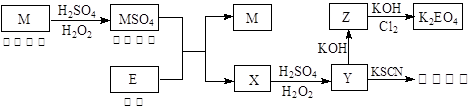
 和
和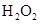 混合液的离子方程式: 。
混合液的离子方程式: 。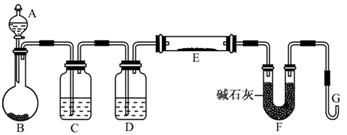
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁与盐酸反应生成氯化铁和氢气 | B.常温下铁在浓硫酸中钝化 |
| C.铁在氧气中燃烧生成物为三氧化二铁 | D.纯铁(块状)是黑色金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com