
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:
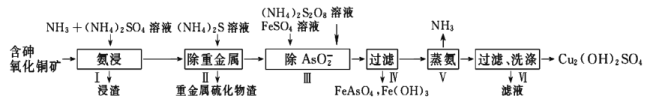
(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
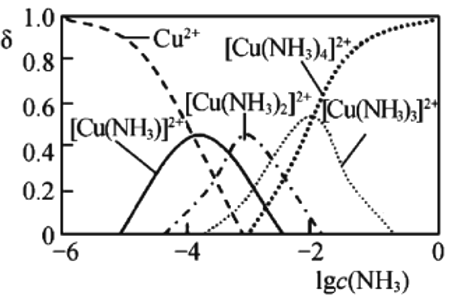
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
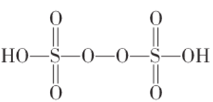
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
【答案】
![]() 温度过高,会加速NH3的挥发
温度过高,会加速NH3的挥发 ![]() +6 生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒
+6 生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒 ![]()
【解析】
含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]与氨气,硫酸铵反应生成![]() 、
、![]() 和水,加入硫化铵得到重金属硫化物渣和滤液,向滤液中加入硫酸亚铁和
和水,加入硫化铵得到重金属硫化物渣和滤液,向滤液中加入硫酸亚铁和![]() ,得到FeAsO4、Fe(OH)3和
,得到FeAsO4、Fe(OH)3和![]() ,
,![]() 蒸氨得到
蒸氨得到![]() 、氨气和硫酸铵。
、氨气和硫酸铵。
(1)过程中可循环利用物质是氨气,氨气的电子式是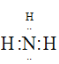 ;故答案为:
;故答案为: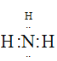 。
。
(2)①CuO被浸取时,CuO与氨气和硫酸铵反应生成水和![]() ,其离子方程式为
,其离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。
②氨气易挥发,因此浸取温度不宜超过55℃;故答案为:温度过高,会加速NH3的挥发。
③书写出反应方程式![]() ,根据方程式知a mol
,根据方程式知a mol![]() 全部浸出为
全部浸出为![]() 需要5amol NH3,根据图象,当lg c(NH3)=0时,
需要5amol NH3,根据图象,当lg c(NH3)=0时,![]() 物质的量分数为1,此时c(NH3)=1 molL1,因此原浸取液中起始时c(NH3)应满足的条件是
物质的量分数为1,此时c(NH3)=1 molL1,因此原浸取液中起始时c(NH3)应满足的条件是![]() ;故答案为:
;故答案为:![]() 。
。
(3)①已知![]() 结构式如图,左边的Sspan>—O单键,O—H键,说明O为-2价,S=O双键,O为-2价,过氧根中氧为-1价,根据此结构确定和化合价代数和为0,得到
结构式如图,左边的Sspan>—O单键,O—H键,说明O为-2价,S=O双键,O为-2价,过氧根中氧为-1价,根据此结构确定和化合价代数和为0,得到![]() 中S元素的化合价为+6;故答案为:+6。
中S元素的化合价为+6;故答案为:+6。
②![]() 需过量,与
需过量,与![]() 充分反应生成铁离子,
充分反应生成铁离子,![]() 氧化
氧化![]() 使之变为沉淀,另一目的是生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒;故答案为:生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒。
使之变为沉淀,另一目的是生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒;故答案为:生成的Fe(OH)3[或Fe(OH)3-Fe(OH)2]絮状沉淀吸附FeAsO4等含砷微粒。
(4) “蒸氨”是![]() 受热反应生成氨气、硫酸铵和
受热反应生成氨气、硫酸铵和![]() ,反应的化学方程式为
,反应的化学方程式为![]() ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】次磷酸钠![]() 可用于化学镀镍。将黄磷
可用于化学镀镍。将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() ,
,![]() 是一种无色、有毒的可燃性气体,与
是一种无色、有毒的可燃性气体,与![]() 溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
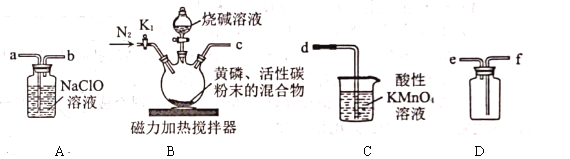
①装好药品,②连接装置,检查气密性,③打开![]() ,再通入一段时间
,再通入一段时间![]() ,④将反应所得的次磷酸钠分离出来,⑤关闭
,④将反应所得的次磷酸钠分离出来,⑤关闭![]() ,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开
,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开![]() 通入
通入![]() 一段时间。请回答下列问题:
一段时间。请回答下列问题:
(1)正确实验操作步骤的顺序是________(填序号)。
(2)实验装置中各导管口的连接顺序是________(填装置中的小写字母)。
(3)在黄磷中混入活性炭粉末的作用是________。
(4)先滴加烧碱溶液,再打开磁力加热搅拌器可能的原因是________。
(5)装置![]() 中反应的化学方程式是________。
中反应的化学方程式是________。
(6)![]() 和
和![]() 的溶解度
的溶解度![]() 如下:
如下:
|
| |
| 37 | 39 |
| 100 | 667 |
实验结束后,将A中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为________,然后________、冷却结晶、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(7)测定产品的纯度:取产品![]() 克配成
克配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,酸化后加入
于锥形瓶中,酸化后加入![]() 碘水于暗处充分反应得
碘水于暗处充分反应得![]() ,然后以淀粉溶液作指示剂,用
,然后以淀粉溶液作指示剂,用![]() 溶液滴定至终点,平均消耗
溶液滴定至终点,平均消耗![]() ,若其它杂质不参加反应,则产品纯度表达式为________。(已知:
,若其它杂质不参加反应,则产品纯度表达式为________。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
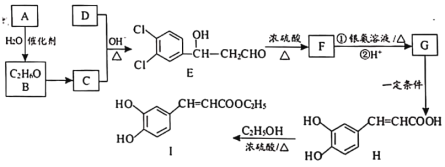
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
(6)季戊四醇(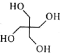 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺如图所示,下列有关此工艺操作不正确的是
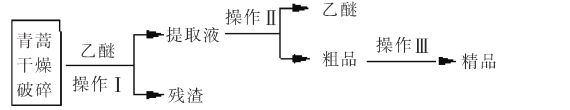
A.操作Ⅲ的主要过程是:加水溶解、蒸发浓缩、冷却结晶、过滤
B.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
C.操作Ⅱ是蒸馏,利用了乙醚沸点低回收利用。
D.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某兴奋剂乙基雌烯醇的结构如图所示。下列叙述正确的是( )

A.该物质可以视为酚类
B.能使溴的四氯化碳溶液褪色
C.该物质分子中的所有碳原子均共面
D.在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”“<”表示下列各组能级的能量高低。
Ⅰ.(1)4s___3d;
(2)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:
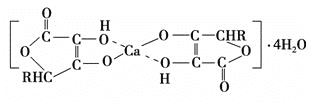
该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键 C.非极性共价键 D.配位键
Ⅱ.下列物质中:N2、H2O、Na2O、Ar、H2O2、KOH、NaF、Na2SO4
(1)只含有共价键的物质是______;
(2)只含有离子键的物质是______;
(3)既含有离子键,又含有共价键的物质______;
(4)不存在化学键的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。
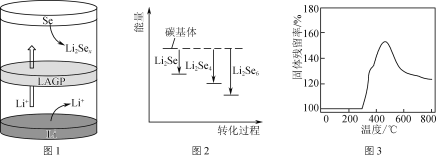
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=![]() ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z是原子序数依次增大的短周期主族元素。R的最外层电子数是内层电子数的两倍,X2W2可用于呼吸面具,Y的主族序数与周期数相等,Z的氢化物的分子式为H2 Z。回答下列问题:
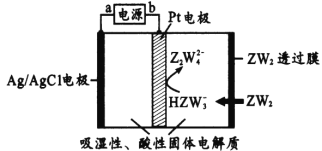
(1)Z在周期表中的位置是_____,Y的原子结构示意图_______。
(2)R2 Z的结构式是_______,X2 Z2的电子式是______。
(3)XYW2溶液呈____性(填“酸”、“碱”或“中”),原因是(用离子方程式表示)________。
(4)某传感器可以检测空气中ZW2的含量,工作原理如上图所示。则其阴极电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com