
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺如图所示,下列有关此工艺操作不正确的是
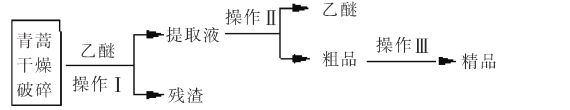
A.操作Ⅲ的主要过程是:加水溶解、蒸发浓缩、冷却结晶、过滤
B.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
C.操作Ⅱ是蒸馏,利用了乙醚沸点低回收利用。
D.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
科目:高中化学 来源: 题型:
【题目】轻质氧化镁和硼酸(H3BO3)都是重要的化工原料,可采用硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如图:
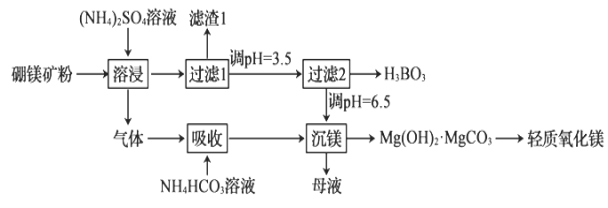
下列叙述错误的是( )
A.Fe2O3、Al2O3都不能溶于(NH4)2SO4溶液
B.进入“吸收”工序中的气体为NH3
C.若“过滤2”时调节溶液的碱性越强得到的硼酸越多
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述不正确的是( )
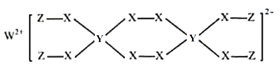
A.简单氢化物的稳定性:X>YB.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为弱酸D.该化合物中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
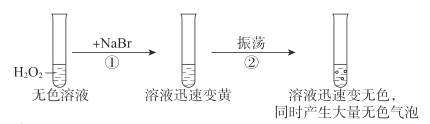
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
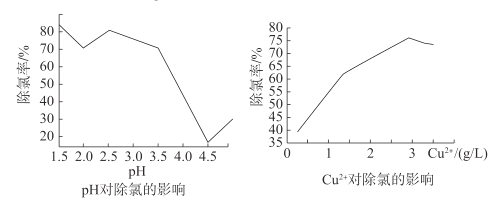
根据图,除去该电解液中Cl-的最佳条件是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
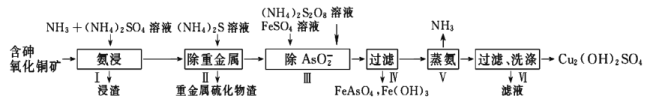
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:
(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
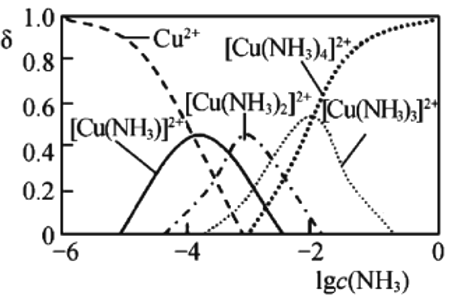
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
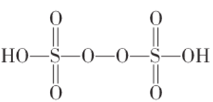
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。
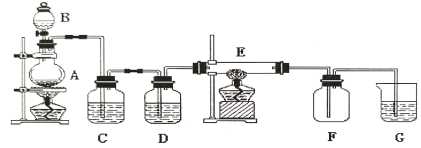
请回答下列问题:
(1)仪器A的名称是_________;B中盛装的药品是_____________;
(2)将实验室制氯气的化学方程式补充完整:MnO2+4HCl(浓)![]() ________ + Cl2↑+ 2H2O;
________ + Cl2↑+ 2H2O;
(3)C装置的作用是____________;D装置的作用是____________;
(4)E中发生化学反应的方程式为__________________;
(5)烧杯G中氢氧化钠溶液的作用是_______________;其发生反应的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
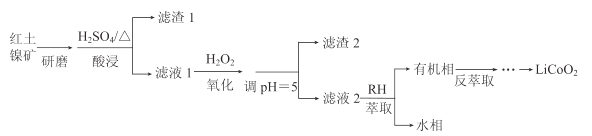
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
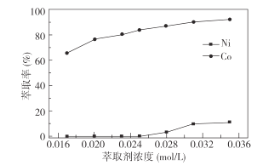
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com