
【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
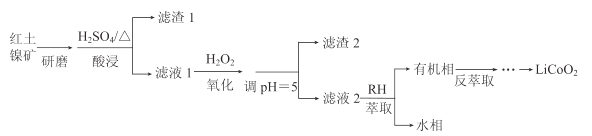
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
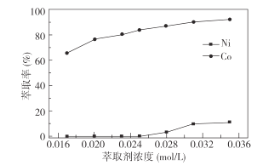
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
【答案】研磨加热 H2O2+2Fe2++2H+=2Fe3++2H2O Fe(OH)3、Al(OH)3 0.025 强酸性 Co2++2HCO![]() =CoCO3↓+H2O+CO2↑ 相同条件下,(NH4)2CO3碱性更强,且Co2(OH)2CO3的溶解度小 4CoCO3+2Li2CO3+O2
=CoCO3↓+H2O+CO2↑ 相同条件下,(NH4)2CO3碱性更强,且Co2(OH)2CO3的溶解度小 4CoCO3+2Li2CO3+O2![]() 4LiCoO2+6CO2
4LiCoO2+6CO2
【解析】
红土镍矿经过研磨增大酸浸时的接触面积,加硫酸后金属氧化物溶解得到相应的硫酸盐,二氧化硅不溶于硫酸成为滤渣1,滤液1中加过氧化氢将亚铁离子氧化成三价铁离子,调剂pH到5使铁离子和铝离子转变成氢氧化物沉淀,滤渣2为氢氧化铝和氢氧化铁,滤液2进行萃取得到有机相,再反萃取,经过处理得到钴酸锂(LiCoO2),据此分析解答。
(1)研磨可以增大反应物间的接触面积,提高反应速率,加热、升高温度能增大反应速率,故答案为:研磨、加热;
(2) ①H2O2的作用是将Fe2+氧化为Fe3+,加入H2O2发生反应H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
②根据以上分析滤渣2主要成分是氢氧化铝和氢氧化铁,故答案为:Fe(OH)3、Al(OH)3;
(3) ①根据萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响图可知,当萃取剂浓度的为0.025 mol/L时,Co的萃取率相对较高,且此时Ni的萃取率接近0,故答案为:0.025;
②根据萃取反应平衡Co2+(水相)+2RH(有机相)CoR2(有机相)+2H+(水相)可知,酸性增强时平衡逆向移动,有利于Co重新进入水相,故答案为:强酸性;
(4) ①向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀,发生的反应为:Co2++2HCO![]() =CoCO3↓+H2O+CO2↑,故答案为:Co2++2HCO
=CoCO3↓+H2O+CO2↑,故答案为:Co2++2HCO![]() =CoCO3↓+H2O+CO2↑;
=CoCO3↓+H2O+CO2↑;
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,主要因为碳酸根离子的水解程度比碳酸氢根离子强,溶液的碱性更强,且Co2(OH)2CO3的溶解度小,故答案为:相同条件下,(NH4)2CO3碱性更强,且Co2(OH)2CO3的溶解度小;
③将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2,反应中Co元素的化合价由+2价升至+3价,O元素的化合价由0价降至-2价,根据得失电子守恒和原子守恒,反应的方程式为:4CoCO3+2Li2CO3+O2![]() 4LiCoO2+6CO2,故答案为:4CoCO3+2Li2CO3+O2
4LiCoO2+6CO2,故答案为:4CoCO3+2Li2CO3+O2![]() 4LiCoO2+6CO2;
4LiCoO2+6CO2;


科目:高中化学 来源: 题型:
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺如图所示,下列有关此工艺操作不正确的是
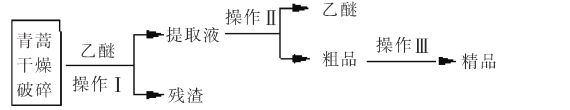
A.操作Ⅲ的主要过程是:加水溶解、蒸发浓缩、冷却结晶、过滤
B.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
C.操作Ⅱ是蒸馏,利用了乙醚沸点低回收利用。
D.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__。
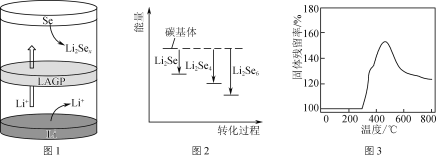
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=![]() ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池裝置如图所示,下列说法不正确的是( )
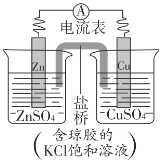
A.锌电极上发生反应:Zn-2e-=Zn2+
B.电子从锌片流向铜片
C.盐桥中K+移向ZnSO4溶液
D.理论上,当6.5gZn溶解时析出6.4gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
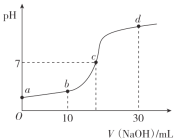
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法错误的是
A.1 L 0.1 mol/L NH4 NO3溶液中含有氮原子总数为0.2 NA
B.7.8 g Na2 O2与水完全反应,转移的电子数为0.2 NA
C.2.8 g CO和N2混合气体中含有质子数为1.4 NA
D.标准状况下,2. 24 L环丙烷中化学键数目为0.9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z是原子序数依次增大的短周期主族元素。R的最外层电子数是内层电子数的两倍,X2W2可用于呼吸面具,Y的主族序数与周期数相等,Z的氢化物的分子式为H2 Z。回答下列问题:
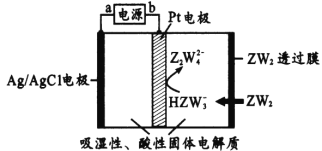
(1)Z在周期表中的位置是_____,Y的原子结构示意图_______。
(2)R2 Z的结构式是_______,X2 Z2的电子式是______。
(3)XYW2溶液呈____性(填“酸”、“碱”或“中”),原因是(用离子方程式表示)________。
(4)某传感器可以检测空气中ZW2的含量,工作原理如上图所示。则其阴极电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,如右图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
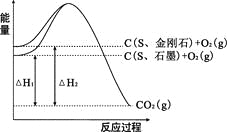
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是
A | B | C | D | |
实验方案 |
置于光亮处 |
|
|
|
实验目的 | 验证甲烷与氯气发生化学反应 | 中和热的测定 | 验证乙炔的还原性 | 验证铁钉发生析氢腐蚀 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com