
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
【答案】D
【解析】溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应后离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LNaOH溶液滴定CH3COOH溶液的滴定曲线,则A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,A错误;B.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,B错误;C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水的电离程度:B<C<A,C错误;D.定量分析可知,D点溶液中,c(Na+)=1.5c(Cl-),根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),则c(Cl-)=2c(OH-)-2c(H+),D正确;答案选D。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。
出发合成BHT的方法有如下两种。
下列说法错误的是


A. 方法一的反应类型是加成反应
B. 推测BHT在水中的溶解度小于苯酚
C. BHT与![]() 都能使酸性KMnO4褪色
都能使酸性KMnO4褪色
D. 从绿色化学角度分析方法二优于方法一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
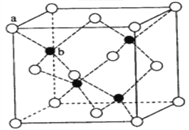
(1)锌元素在周期表中的位于第______周期_____族, 属于_____区;
(2)基态锌原子的价电子排布式为_________;
(3)一般锌元素常表现为+2 价的原因是_____;
(4)立方硫化锌晶体的每个晶胞中含有_____个锌离子, 其配位数为_____;含有_____个硫离子,其配位数为_____;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是
A.最高正化合价:P>N>CB.原子半径:Na>Mg>Cl
C.热稳定性:H2O>HF>H2SD.酸性:H2CO3>H3PO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质;(1) 溴乙烷;(2) 苯;(3) 聚氯乙烯;(4) 裂化汽油;(5) 聚1,3-丁二烯;(6) 乙二醇;(7) 邻二甲苯(8)亚硫酸氢钠;既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的有( )
A. 3种 B. 4种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2![]()
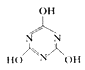 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中,第一电离能最大的元素是____________(填元素符号),电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子、碳原子的杂化轨道类型分别为____________,NH3、CO2、H2O三种分子中化学键的键角由大到小的顺序为____________。
(3)上述四种分子中所有原子一定共平面的是____________,反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如图所示:

①该晶体的化学式为____________,晶体中氧原子的配位数是____________。
②若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:

已知:![]()
请回答下列问题:
(1)D中含氧官能团的名称_________。
(2)反应④的反应类型是:_________,G的分子式为:_________。
(3)下列有关说法错误的是_________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.1 mol D能与2 mol NaOH反应
(4)反应②的化学方程式:_________;
(5)写出同时满足下列条件B的一种同分异构体的结构简式:_________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③核磁共振氢谱有三组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向稀盐酸中加铁粉:2Fe+6H+═2Fe3++3H2↑
B. 盐酸与硝酸银溶液反应:Cl﹣+Ag+═AgCl↓
C. 氢氧化钡溶液与稀硫酸反应:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钙溶于稀盐酸中:CO32﹣+2H+═CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com