
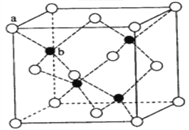
【题目】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
(1)锌元素在周期表中的位于第______周期_____族, 属于_____区;
(2)基态锌原子的价电子排布式为_________;
(3)一般锌元素常表现为+2 价的原因是_____;
(4)立方硫化锌晶体的每个晶胞中含有_____个锌离子, 其配位数为_____;含有_____个硫离子,其配位数为_____;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____pm(列式表示)。
【答案】 四 IIB ds 3d104s2 基态锌原子失去两个电子后, 变为第三层全满的稳定状态 4 4 4 4 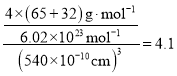
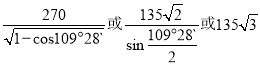
【解析】(1)锌是30号元素,在周期表中位于第4周期IIB族, 价电子排布式为3d104s2,属于ds区的元素,故答案为:四; IIB; ds ;
(2)基态锌原子的价电子排布式为3d104s2,故答案为:3d104s2;
(3)基态锌原子失去两个电子后, 变为第三层全满的稳定状态,因此锌元素常表现为+2 价,故答案为:基态锌原子失去两个电子后, 变为第三层全满的稳定状态;
(4)晶胞中含有白色球位于顶点和面心,共含有8×![]() +6×
+6×![]() =4,黑色球位于体心,共4个,立方硫化锌晶体的每个晶胞中含有4个锌离子,每个 锌离子与周围的4个硫离子构成正四面体结构,其配位数为4;含有4个硫离子,其配位数也为4,故答案为:4;4;4;4;
=4,黑色球位于体心,共4个,立方硫化锌晶体的每个晶胞中含有4个锌离子,每个 锌离子与周围的4个硫离子构成正四面体结构,其配位数为4;含有4个硫离子,其配位数也为4,故答案为:4;4;4;4;
(5)晶胞中含有白色球位于顶点和面心,共含有8×![]() +6×
+6×![]() =4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为[4×(87÷6.02×1023)g]÷(540.0×10-10cm)3=4.1gcm-3;
=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为[4×(87÷6.02×1023)g]÷(540.0×10-10cm)3=4.1gcm-3;
b位置黑色球与周围4个白色球构成正四面体结构,黑色球与两个白色球连线夹角为109°28′,a位置白色球与面心白色球距离为540.0pm×![]() =270
=270![]() pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270
pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270![]() )2,解得y=
)2,解得y=![]() ,故答案为:4.1;
,故答案为:4.1; ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钡不溶于水,所以硫酸钡是非电解质
B. 二氧化碳溶于水可以导电,所以,二氧化碳是电解质
C. 固态磷酸是电解质,所以磷酸在熔化时或溶于水时都能导电
D. 液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
B. 0.1 mol·L-1 NH4Cl 溶液与 0.1 mol·L-1 氨水等体积混合(pH>7):c(NH3 ·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)=c(Br-)
D. 向 0.10 mol·L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+) = 2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(l)等质量的以上三种物质完全燃烧时,消耗O2的量最多的是______(填分子式),该烃与氧气反应的化学方程式为_________;
(2)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____(填结构简式), 生成水最多的是_______(填结构式);
(3)相同状况下,等体积的以上下种物质完全燃烧时,消耗O2的量最多的是_____(填物质名称),该烃电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”对此段话的说明中肯定错误的是( )
A. 绿矾的化学式为FeSO4·7H2O B. 绿矾分解过程中没有发生电子的转移
C. “色赤”物质可能是Fe2O3 D. 流出的液体中可能含有硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质及其用途的描述,正确的是
①Al2O3(作耐火坩埚) ②KAl(SO4)2·12H2O(作水的消毒剂)③Fe2O3(作黄色油漆和涂料)
④NaHCO3(作食用碱) ⑤钠、钾、锶、钡等化合物(作烟花的焰色)⑥Na2O2(作呼吸面具供氧剂)
A.①④⑤⑥ B.①②⑤⑥ C.①③④⑤ D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com