
【题目】下列说法正确的是( )
A. 硫酸钡不溶于水,所以硫酸钡是非电解质
B. 二氧化碳溶于水可以导电,所以,二氧化碳是电解质
C. 固态磷酸是电解质,所以磷酸在熔化时或溶于水时都能导电
D. 液态氯化氢不能导电,但氯化氢是电解质
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】有下列六种基团:①苯基 ②醛基 ③羟基 ④羧基 ⑤乙基 ⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的结构简式。
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应________________。
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有______________、 ____________。
(3)不稳定的两元弱酸__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在______对自旋方向相反的电子。第一电离能介于B与N之间的第二周期元素有______种。
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为______须标出配位键),氮原子在M、N分子中的杂化方式分别为_________。
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为_________。
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H ![]() CH3CH2OH
CH3CH2OH 
上图中乙酸分子键角1>键角2,其原因为_____________。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。

①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“![]() ”和画“×”分别表明B与P的相对位置_____________。
”和画“×”分别表明B与P的相对位置_____________。
②已知晶胞边长为apm,则磷化硼的密度是______g/cm3(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。

(1)关于该反应的下列说法中,其△H____0。(填“大于”、“小于”或“等于”), 且在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为______________________
(3)温度降低,平衡常数K_____________(填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )_________(填“大于”“小于”或“等于”)乙容器内n(CH3OH )
(5)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为_______________________
②若以石墨为电极,电解硫酸铜溶液,写出电解的化学反应方程式___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种离子,向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)( )
A. ① B. ①②④ C. ①③⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是______________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是__________________________。
(3)实验过程中,可循环使用的物质分别为_______、_______。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是______________,其原理是______________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。
出发合成BHT的方法有如下两种。
下列说法错误的是


A. 方法一的反应类型是加成反应
B. 推测BHT在水中的溶解度小于苯酚
C. BHT与![]() 都能使酸性KMnO4褪色
都能使酸性KMnO4褪色
D. 从绿色化学角度分析方法二优于方法一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
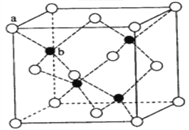
(1)锌元素在周期表中的位于第______周期_____族, 属于_____区;
(2)基态锌原子的价电子排布式为_________;
(3)一般锌元素常表现为+2 价的原因是_____;
(4)立方硫化锌晶体的每个晶胞中含有_____个锌离子, 其配位数为_____;含有_____个硫离子,其配位数为_____;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____pm(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com