
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
分析 A、电解质必须是化合物;
B、在水溶液中或熔融状态下能导电的化合物为电解质;
C、在水溶液中或熔融状态下能导电的化合物为电解质;
D、胶体区别于其他分散系的本质是粒子的直径大小不同.
解答 解:A、电解质必须是化合物,铜是单质,故既不是电解质也不是非电解质,故A错误;
B、BaSO4难溶于水,但在熔融状态下能导电,所以BaSO4为电解质,故B错误;
C、在水溶液中或熔融状态下能导电的化合物为电解质,氯化钠溶于水后和在熔融状态下能导电,为电解质,故C正确;
D、胶体区别于其他分散系的本质是粒子的直径大小不同,故D错误;
故选C.
点评 本题考查了电解质、非电解质的判断以及胶体区别于其他分散系的本质特征,应注意的是单质既不是电解质也不是非电解质,难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入HCl | ||
| C. | 加入适量的NaOH(固体) | D. | 加入固体NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置或操作 |  | 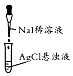 | 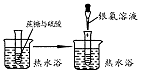 | 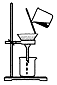 |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
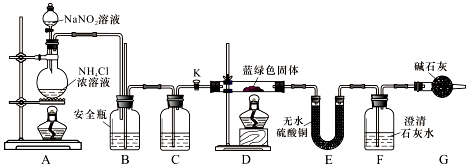
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SiO3溶液的pH | Na2SiO3溶液的pH大 | 非金属性:C>Si |
| B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备CO2 |
| C | 将4mL 0.01mol/L酸性KMnO4溶液与2mL 0.lmol/L草酸溶液混合 | KMnO4溶液褪色的速率先慢后加快 | 增大反应物浓度, 反应速率加快 |
| D | 将NO2气体通入石蕊试液中 | 溶液变红 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X被氧化,Y 是氧化剂 | B. | Y被还原,X是氧化剂 | ||
| C. | X是还原剂,Y被氧化 | D. | Y被还原,X2+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
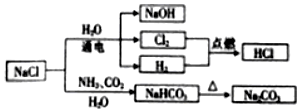
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 图中所示转化反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | H2与Cl2反应时产生苍白色火焰并形成白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准况状下,44.8 L四氯筑化碳含有的分子数为2NA | |
| B. | 0.1mol/L氯化铝溶液中含有Al3+数为0.1 NA | |
| C. | 1.8 g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com