
分析 (1)要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据电荷守恒计算溶液中铵根离子浓度;
(2)依据质量守恒定律及m=cVM计算需要溶质的质量;
(3)依据溶液中所含离子成分及浓浓度关系判断解答;稀释过程中溶质的物质的量不变,据此计算出稀释后溶液中氯化铵的浓度.
解答 解:(1)所得溶液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据溶液中电荷守恒规律可知:c(Cl-)+2c(SO42-)=c(K+)+c(NH4+),即:0.4mol/L+2×0.4mol/L=0.4mol/L+c(NH4+),解得:c(NH4+)=0.8mol/L,
故答案为:0.8mol/L;
(2)要求该培养液中c(Cl-)=c(K+)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要氯化钾的物质的量浓度为0.4mol/L,需要氯化钾固体质量为:m=0.4mol/L×0.5L×74.5g/mol=14.9g;
要使c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,则需要硫酸铵的物质的量浓度为0.4mol/L,需要硫酸铵固体质量为:m=0.4mol/L×0.5L×132g/mol=26.4g,
故答案为:26.4;
(3)配制含有NH4+、Cl-、K+、SO42-的植物培养液500mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,c(NH4+)=0.8mol/L,需要硫酸钾的物质的量为:$\frac{1}{2}$×0.4mol/L×0.5L=0.1mol,需要硫酸铵的物质的量为:0.4mol/L×0.5L-0.1mol=0.1mol,需要氯化铵的物质的量为:0.8mol/L×0.5L-0.1mol×2=0.2mol;
稀释过程中氯化铵的物质的量不变,则稀释后溶液中氯化铵的物质的量浓度为:$\frac{0.2mol}{0.8L}$=0.25mol/L,
故答案为:K2SO4;0.1mol;0.2mol;0.25mol/L.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题知识点较多,充分考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
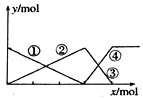
| A. | ①线表示AlO2-的物质的量的变化 | B. | x表示AlCl3的物质的量 | ||
| C. | ③线表示Al(OH)3的物质的量的变化 | D. | ④线表示AlO2-的物质的量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使上述反应发生的物质是KMnO4 | |
| B. | 该氧化还原反应的离子方程式中水的计量数为5 | |
| C. | 该氧化还原反应中氧化剂是Fe2O42-,发生氧化反应 | |
| D. | 有1mol还原剂参与反应时,转移4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
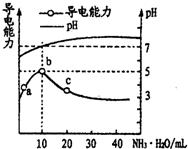 常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析正确的是( )| A. | a→b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液的pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(OH-)>c(H+) | |
| D. | a、b、c三点NH3•H2O的电离常数均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液和Ca(OH)2溶液 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Na和稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com