
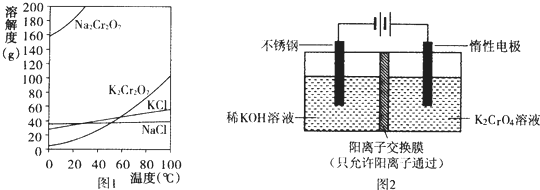
分析 (1)Na2Cr2O7水溶液中加KCl,加热浓缩、冷却结晶,可得到K2Cr2O7;
(2)①与电源的负极相连作阴极;阴极上氢离子得电子生成氢气;
②阳极上溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动;
③设K2CrO4为1mol,则K+为2mol,铬酸钾的转化率达到x,则生成为K2Cr2O70.5xmol,K2CrO4剩余为1-xmol,据此计算;
(3)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,根据电子守恒和原子守恒书写方程式;
②pH约为8,则c(OH-)=10-6mol/L,根据Ksp[Cr(OH)3]≈6×10-31计算c(Cr3+),再求出质量浓度.
解答 解:(1)由图可知Na2Cr2O7的溶解度较大,K2Cr2O7的溶解度较小,Na2Cr2O7水溶液中加KCl,加热浓缩、冷却结晶,可得到K2Cr2O7;
故答案为:KCl;冷却结晶;
(2)①与电源的负极相连作阴极;阴极上氢离子得电子生成氢气,则阴极的电极方程式为:2H2O+2e-=2OH-+H2↑;
故答案为:阴;2H2O+2e-=2OH-+H2↑;
②阳极上溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动;
故答案为:阳极OH-放电,溶液中H+浓度增大,使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7;
③设K2CrO4为1mol,则K+为2mol,铬酸钾的转化率达到x,则生成为K2Cr2O70.5xmol,K2CrO4剩余为1-xmol,
则阳极液中K与Cr的物质的量之比为2:(1-x+0.5x)=2:(1-0.5x);
故答案为:2:(1-0.5x);
(3)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
故答案为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
②pH约为8,则c(OH-)=10-6mol/L,已知Ksp[Cr(OH)3]≈6×10-31,c(Cr3+)=$\frac{6×1{0}^{-31}}{(1{0}^{-6})^{3}}$=6×10-13mol/L,则1L溶液中Cr元素的质量为6×10-13mol×52g/mol=3.126×10-11g≈3×10-8mg,则理论上Cr3+浓度约为3×10-8mg/L;
故答案为:3×10-8.
点评 本题考查物质的制备的综合应用,把握物质的制备方法、电解原理、溶度积常数的计算为解答的关键,注意信息的应用及相关计算,侧重分析与实验、计算能力的综合考查,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 乙醇在氧气中燃烧 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: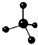 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: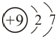 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2[PtF6]中只含离子键 | B. | O2[PtF6]中氧元素化合价为+1 | ||
| C. | 反应中O2是氧化剂,PtF6是还原剂 | D. | 每生成1molO2PtF6转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
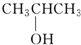 ⑨${\;}_{6}^{13}$C (填序号)
⑨${\;}_{6}^{13}$C (填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
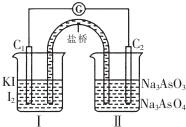 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com