
| A、3.5g | B、3g |
| C、2g | D、4.5g |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
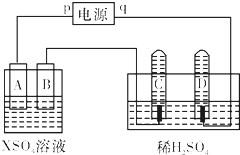 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
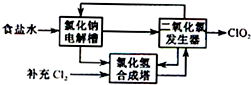 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:
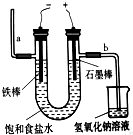
| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
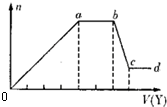 ①若Y是盐酸,则溶液中含有的金属阳离子是
①若Y是盐酸,则溶液中含有的金属阳离子是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com