
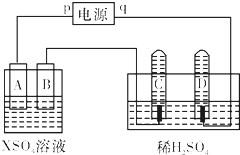
 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 0.128g |
| M |
| 0.128g×2mol |
| 0.004mol×1mol |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| 两级材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁的原子失电子能力比钠弱 |
| B、氟的氢化物很稳定 |
| C、硫的氢化物比氧的氢化物更不稳定 |
| D、氢氧化钠是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水鉴别Al3+、Mg2+和Ag+ |
| B、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C、用水鉴别乙醇、甲苯、硝基苯 |
| D、用KMnO4酸性溶液鉴别苯、甲苯、环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5g | B、3g |
| C、2g | D、4.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
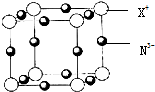 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、39:24:13 |
| B、22:7:14 |
| C、13:8:29 |
| D、26:16:57 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com