
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,
(1)其变化可表述为,请配平下述化学方程式并用双线桥表示此反应转移的电子数目及方向.
配平:KClO3+HCl(浓)=KCl+ClO2↑+Cl2↑+H2O
双线桥:
(2)浓盐酸在反应中显示出来的性质是(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)氧化剂是 , 氧化产物是 .
【答案】
(1)2;4;2;2;1;2;![]()
(2)②
(3)KClO3;Cl2
【解析】解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由﹣1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒,可知未知物是水,水的系数是2,其反应方程式为:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,电子转移如下: ![]()
所以答案是:2;4;2;2;1;2; ![]() ;(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由﹣1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,
;(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由﹣1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各有一半,
故选:②;(3)KClO3中氯元素化合价由+5价降低为ClO2中+4价,则KClO3为氧化剂,HCl中氯元素化合价由﹣1价升高为Cl2中0价,则还原剂为HCl,生成Cl2为氧化产物;所以答案是:KClO3;Cl2 .


科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:

(1)植物细胞中E主要是指________,它属于_______糖,基本单位是___________ 。
(2)F是指_________;除此之外,脂质还包括_______和 _______。相同质量的E和F都彻底氧化分解,释放能量较多的是______。
(3)C是指________, 共有_____种,其通式是 _____________________________。
(4)人的遗传物质H是指_________,其基本单位D是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,23g NO2含有NA个氧原子
B.标准状况下,22.4L H2O含有NA个H2O分子
C.含10 NA个电子的N2分子的物质的量是1mol
D.0.1mol/L的Ba(OH)2溶液中,OH﹣的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”﹣﹣盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过. 
(1)请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线) .
(2)在能“吃掉”盐酸的化学反应中,写出属于酸和碱中和反应的方程式:
(3)在不能与盐酸反应的物质中,属于非电解质的是(填写物质序号).
(4)写出物质②的电离方程式
(5)写出盐酸与碳酸钙反应的离子方程式:
(6)写出Ag++Cl﹣=AgCl↓对应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( ) 
A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题. 
(1)A物质的化学式为;操作1的名称是 .
(2)反应①中加入略过量的A物质的目的是;判断A已过量的实验操作方法是 .
(3)写出反应②的化学方程式: . 如果加入盐酸过量,则对所得到的氯化钠的纯度(填“有”或“没有”)影响.
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是元素周期表的一部分,请回答下列问题。
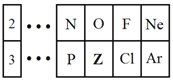
(1)Z元素在元素周期表中位于第________族。
(2)Z的原子半径__________(填“大于”、“小于”或“等于”)Si的原子半径。
(3)Cl元素的非金属性比Z元素的__________(填“强”或“弱”)。
(4)Z元素的气态氢化物的化学式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com