
【题目】Ⅰ.已知X元素和碳元素同主族,位于周期表中的第1个长周期,是最早使用的半导体材料。短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是XY4。
(1)元素Y原子核外电子有___________种不同运动状态。
(2)X元素原子的价电子的轨道表示式为______________________________.
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(4)该化合物分子为________(填“极性”或“非极性”)分子。
Ⅱ. 已知X、Y为第3周期的两种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y单质与X的最高价氧化物对应的水化物反应的化学方程式为:_________。
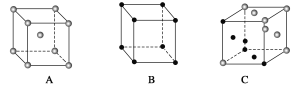
(6)X晶体采用的堆积方式与金属钾相同,X晶体采用下列________(填字母)堆积方式。
(7)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是____________________。
【答案】17 ![]() 共价键 非极性 2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑) A MgO>CaO>NaCl>KCl
共价键 非极性 2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑) A MgO>CaO>NaCl>KCl
【解析】
Ⅰ.X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4,据此分析解答(1)-(4);
Ⅱ. X、Y为第3周期的两种元素,根据电离能的数值可知,X最外层只有1个电子,为Na元素;Y最外层有3个电子,为Al元素,据此分析解答(5)-(7)。
Ⅰ.根据上述分析,X为Ge元素,Y为Cl元素,化合物XY4为GeCl4。
(1)Y为Cl元素, Cl元素是17号元素,核外电子有17种不同运动状态,故答案为:17;
(2)X为Ge元素,位于第四周期第ⅣA族,Ge元素是32号元素,基态原子核外电子排布式为ls22s22p63s23p63d104s24p2,价电子的轨道表示式为![]() ,故答案为:
,故答案为: ![]() ;
;
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y的电负性的差值为0.9<1.7,X与Y之间形成共价键,故答案为:共价键;
(4) GeCl4中Ge的价层电子对数=4+0=4,采用sp3杂化,为正四面体结构,分子中正负电荷的重心重合,属于非极性分子,故答案为:非极性;
Ⅱ. 根据上述分析,X为Na元素;Y为Al元素。
(5)铝单质与钠的最高价氧化物对应的水化物氢氧化钠反应的化学方程式为2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑),故答案为:2Al+2NaOH+6H2O=2Na [Al(OH)4]+3H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑);
(6)钠属于体心立方堆积,故答案为:A;
(7)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子所带电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,所带电荷数越多,晶格能越大,则离子晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,故答案为:MgO>CaO>NaCl>KCl。


科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
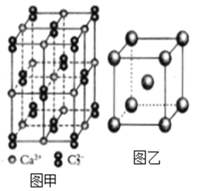
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LSO2溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.分子式为C2H6O的某种有机物4.6g,含有C-H键的数目一定为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:

下列说法正确的是____(选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。

①不同催化剂存在下,氨气分解反应活化能最大的是___(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
(4)关于合成氨工艺的理解,下列正确的是___。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[![]() (NH3)]。
(NH3)]。

①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)____vB(NH3)(填“>”、“<”或“=”)。
②在250℃、1.0×104kPa下,H2的转化率为______%(计算结果保留小数点后1位)。
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
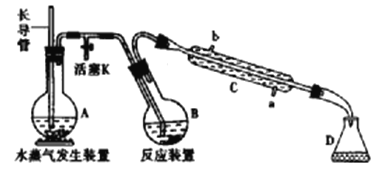
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列物质中:
(1)互为同分异构体的是______
(2)互为同素异形体的是_______
(3)互为同位素的是__________
(4)属于同一种物质的是______
(5)互为同系物的是__________ (填序号)
①液氯和氯气 ②白磷和红磷 ③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2 ④![]() 和
和![]() ⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
Ⅱ.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨C2H6 ⑩H2O2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是_______。
(2)只含离子键的离子化合物是______。
(3)含极性共价键的离子化合物是_________。
(4)含非极性共价键的离子化合物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)写出基态碳原子的电子排布式________________, CO2是_______分子(填“极性”或“非极性”),中心碳原子采取的杂化类型是_____________。
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_________(填编号)。
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸的酸性大于硅酸 d.SiO2+Na2CO3 =Na2SiO3+CO2↑
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K=__________________。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施______________、______________。
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2)。Mg3N2溶于足量的稀硫酸可得到两种正盐,写出该反应的化学方程式__________________________________________________。
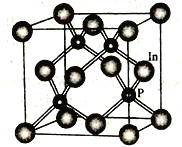
(4)磷化铟是一种半导体材料,其晶胞如下图所示。写出磷化铟的化学式______________;In的配位数(与之距离最近的原子数目)为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com