
����Ŀ��I.̼Ԫ�ع㷺��������Ȼ���У����������������������Ҫ���塣��̼�������ڹ�ҵ���������������й㷺��Ӧ�á�
��1��д����̬̼ԭ�ӵĵ����Ų�ʽ________________�� CO2��_______���ӣ����������������Ǽ�������������̼ԭ�Ӳ�ȡ���ӻ�������_____________��
��2��̼����ͬ����Ԫ�أ�������˵�����߷ǽ��������ǿ������_________�����ţ���
a.CH4���ȶ��Ա�SiH4ǿ b.SiH4�ķе��CH4��
c.̼������Դ��ڹ��� d.SiO2+Na2CO3 =Na2SiO3+CO2��
II.�����裨Si3N4����һ����Ҫ���մɲ��ϣ�����ʯӢ�뽹̿��800�����������ºϳɣ�3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
��1���÷�Ӧ��ƽ�ⳣ������ʽK=__________________����֪ƽ�ⳣ����K(800��)>K(850��)��������Ӧ��__________��Ӧ������������������������
��2����д��������߶�������ת���ʵĴ�ʩ______________��______________��
��3��Mg�ڿ�����ȼ�տ�����������þ��Mg3N2����Mg3N2����������ϡ����ɵõ��������Σ�д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________________________��
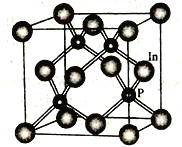
��4��������һ�ְ뵼����ϣ��侧������ͼ��ʾ��д�������Ļ�ѧʽ______________��In����λ������֮���������ԭ����Ŀ��Ϊ_______________��
���𰸡�1s22s22p2��[He] 2s22p2 �Ǽ��� sp ae ![]() ���� ���� ��ѹ��������Ũ�� Mg3N2+4H2SO4=3MgSO4+
���� ���� ��ѹ��������Ũ�� Mg3N2+4H2SO4=3MgSO4+![]() InP 4
InP 4
��������
I.��1��̼ԭ��Ϊ6��Ԫ�أ�����6�����ӣ����ݺ�������Ų����ɣ�������Ų�ʽΪ��1s22s22p2��[He]2s22p2��������̼Ϊֱ���ͷ��ӣ�������������ܹ��غϣ�Ϊ�Ǽ��Է��ӣ�������̼��Cԭ�ӵļ۲���Ӷ���=2+��4-2��2����2=2��Ϊsp�ӻ���
��2��a��CH4���ȶ��Ա�SiH4ǿ����֪C�ķǽ����Ա�Siǿ����aѡ��
b����������鶼�Ƿ��Ӿ��壬���Ӿ���е�����Ӽ�������ǿ���йأ���C��Si�ǽ�����ǿ���أ���b��ѡ��
c��̼�ᡢ����ֱ���C��Si����ۺ����ᣬ̼������Դ��ڹ��ᣬ�����жϷǽ�����Cǿ��Si����cѡ��
d��SiO2+Na2CO3![]() Na2SiO3+CO2�����÷�ӦΪ�����µķ�Ӧ�������¶�����̼�ӷ����ٽ���Ӧ������У����Բ��������ж�C��Si�ķǽ����Ե�ǿ������d��ѡ��
Na2SiO3+CO2�����÷�ӦΪ�����µķ�Ӧ�������¶�����̼�ӷ����ٽ���Ӧ������У����Բ��������ж�C��Si�ķǽ����Ե�ǿ������d��ѡ��
�ʴ�Ϊ��ac��
II.��1����ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ�����ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽΪK��![]() ����֪ƽ�ⳣ����K��800�棩��K��850�棩���������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��
����֪ƽ�ⳣ����K��800�棩��K��850�棩���������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��
��2����߶�������ת���ʣ���ʹƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ�У������¶ȣ���Сѹǿ������N2Ũ�ȵȣ�
��3��Mg�ڿ�����ȼ�տ�����������þ��Mg3N2����Mg3N2����������ϡ����ɵõ��������Σ�����ԭ���غ��֪Ӧ��������狀�����þ����Ӧ�Ļ�ѧ����ʽΪ��Mg3N2+4H2SO4=��NH4��2SO4+3MgSO4��
��4�����ݾ���ͼ��֪���������У�Inԭ����ĿΪ8��1/8+6��1/2=4��Pԭ����ĿΪ4�����������Ļ�ѧʽΪInP��In����λ��Ϊ4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��֪XԪ�غ�̼Ԫ��ͬ���壬λ�����ڱ��еĵ�1�������ڣ�������ʹ�õİ뵼����ϡ�������Ԫ��Yԭ�ӵ��������������ڲ����������3�������γɵĻ�����ķ���ʽ��XY4��
(1)Ԫ��Yԭ�Ӻ��������___________�ֲ�ͬ�˶�״̬��
(2)XԪ��ԭ�ӵļ۵��ӵĹ����ʾʽΪ______________________________.
(3)��X��Y��Ԫ�ص縺�Էֱ�Ϊ2.1��3.0����XY4��X��Y֮��Ļ�ѧ��Ϊ________(�������ۼ����������Ӽ���)��
(4)�û��������Ϊ________(���������������Ǽ�����)���ӡ�
��. ��֪X��YΪ��3���ڵ�����Ԫ�أ���ԭ�ӵIJ��ֵ�����(kJ��mol��1)���±���ʾ��
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y������X������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ��_________��
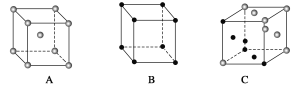
(6)X������õĶѻ���ʽ���������ͬ��X�����������________(����ĸ)�ѻ���ʽ��
(7)NaCl��KCl��MgO��CaO����ṹ���ƣ��������־���ľ������������±���
���� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���־���NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��F�Ǻ���ͬһ��Ԫ�صĻ��������F����ʹʪ��ĺ�ɫʯ����ֽ���������壬A�� B������β������Ҫ�ɷ֣�����֮���ܷ������·�Ӧ��
��![]() ��
��
��![]()
![]() ����
����![]() ��
��
��![]()
(1)д�����ǵĻ�ѧʽ��A______��C______��D______��F______��
(2)д��![]() ��Ӧ�Ļ�ѧ����ʽ������Ҫ����գ�_______________________________�������Ӧ______
��Ӧ�Ļ�ѧ����ʽ������Ҫ����գ�_______________________________�������Ӧ______![]() ����������������������
����������������������![]() ������ԭ��Ӧ��
������ԭ��Ӧ��
(3)��ҵ����C�Ĺ�������һ����ӦΪF������������B��![]() ��д���ò���Ӧ�Ļ�ѧ����ʽ��________________________________��
��д���ò���Ӧ�Ļ�ѧ����ʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״�(CH3OH)����Ӧ�Ļ�ѧ����ʽΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
CH3OH(g)+H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
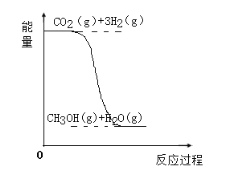
(1)�÷�Ӧ��__��Ӧ(��������������������)���жϵ�������___��
(2)ij�¶�ʱ�������Ϊ2L���ܱ������У�����1molCO2��3molH2�����CO2�����ʵ�����ʱ��仯���±���ʾ��
ʱ��/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
�ӷ�Ӧ��ʼ��5minĩ����CO2��ʾ�ĸ÷�Ӧ��ƽ������Ϊ__����Ӧ��ƽ��ʱ��H2��ת����Ϊ__��Ҫ��ߴ˷�Ӧ�����ʣ����Բ�ȡ___��ʩ(��д2��)��
(3)��ά��(2)���������䣬��˵���÷�Ӧ�Ѵ�ƽ��״̬����__(�����)��
A.v����(CH3OH)=v����(CO2)
B.CO2��H2��CH3OH��H2OŨ����ȵ�״̬
C.CO2��H2��CH3OH��H2O�����ʵ������ֲ����״̬
D.CO2��ת���ʱ��ֲ����״̬
(4)����ԭ���ԭ�������״���Ƴ�ȼ�ϵ����ͼ��
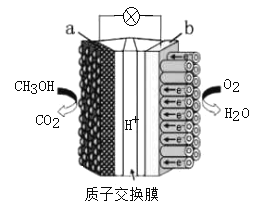
��aΪ__��(����������������)��H+��__������__����Ǩ��(��ͼ����ĸ��)��b����O2������Ӧ�缫��ӦʽΪ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����������뼸�η�̪��Һ����

�ٵ�����X���ϵĵ缫��Ӧʽ�ǣ�_________����X�������۲쵽������____________
��Y�缫�ϵĵ缫��Ӧʽ�ǣ�__________________���ܷ�Ӧ��ѧ����ʽ�ǣ�_____��
��2�� ��Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ��X�缫�IJ�����____��CuSO4��Һ��Ũ�� ____�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�����������˵����ȷ���ǣ���
A.1 mol�����ڹ�����������ȫȼ�ղ���NA��SO3����
B.5.4 g������������NaOH��Һ��Ӧ��ת�Ƶ�����Ϊ0.6NA
C.��״���£�36 g H2O�к�����ԭ����Ϊ1 mol
D.��״���£�22.4 L SO3�к�����ԭ����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�����Ҫ�ɷ�ΪFe3O4��Al2O3��MnCO3��Mg0����MnO2�ȡ���ҵ�Ͻ�����ʯ����������������Ĥ��ⷨ���¼�����ȡ�����ڲ��Ƶ���ɫ��Ч��ˮ������(K2FeO4)����ҵ��������:
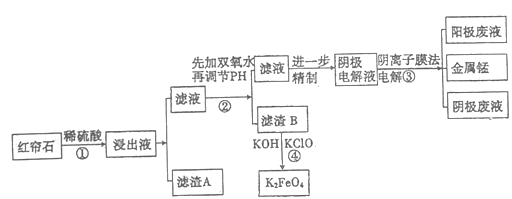
(1)��ϡ�����ȡ��ʯ�Ĺ����У�MnO2�ɽ�Fe2+����ΪFe3+��д���÷�Ӧ�����ӷ���ʽ:________��
(2)����Һ�е������ӳ�H+��Fe2+��Fe3+���_______(�����ӷ���)��
(3)��֪:��ͬ��������������������������������pH���±�:
���� | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
��ʼ������pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
��ȫ������pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
������е�����Һ��pH����6������pH���Լ����ѡ�����������Լ�:_______(��ѡ����ĸ����ͬ)����B�������ʺ�ɽ�һ����ȡK2FeO4����������B���������ѡ�����������Լ�:_____��
a.ϡ���� b.KOH c.��ˮ d.MnCO3 e.CaCO3
(4)����B����Ӧ�����ɸ�Чˮ�����������ӷ���ʽ_______________��
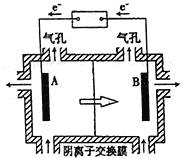
(5)���װ����ͼ��ʾ����ͷ��ʾ��Һ���������ƶ��ķ�������A�缫���ӵ���ֱ����Դ��_____�����������Һ��ϡ���ᣬ��������ֻ���̵���������������11g��ʱ����һ���缫�ϲ����������ڱ�״���µ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������أ�H���п�ʵ��������ʧ������ʹ���������á��ɷ����廯����AΪԭ�Ϻϳ�H��һ�ֺϳ�·������:
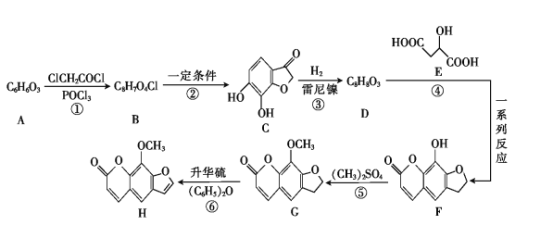
��֪:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
�ش���������:
��1��A�Ļ�ѧ�����ǡ�_____����ϵͳ����������
��2��G�����������ŵ������ǡ���____��
��3��̼ԭ��������4����ͬ��ԭ�ӻ����ʱ,��̼��Ϊ����̼��E��___����������������û����������̼��
��4����Ӧ�ķ�Ӧ�����ǡ�____����
��5��D�Ľṹ��ʽΪ��_____��
��6��F������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ����____��
��7�������廯����W��D��ͬ���칹��,�ܷ���������Ӧ��ˮ�ⷴӦ,��FeCl3��Һ������ɫ��Ӧ;W�ĺ˴Ź���������5���,�������Ϊ1��2��2��2��1����������Ҫ���W��____�֡�
��8���л���M��![]() ����һ����Ҫ�Ļ���ԭ�ϡ�������ڱ����Ӻ��������ȣ�ClCH2COCl��Ϊ��ʼԭ���Ʊ��л���M�ĺϳ�·��____�������Լ����л��ܼ����ã�
����һ����Ҫ�Ļ���ԭ�ϡ�������ڱ����Ӻ��������ȣ�ClCH2COCl��Ϊ��ʼԭ���Ʊ��л���M�ĺϳ�·��____�������Լ����л��ܼ����ã�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�����͵Ķ����������Ʒ������������ɫ��ɫ��ĩ���������ᣬ������ˮ���Ҵ����ܼ���ijʵ��С���ڵ��º�ͨ�백���ļ��������£����ø�����������ⷴӦ��ȡCaO2��8H2O����(�÷�Ӧ��һ�����ȷ�Ӧ)��
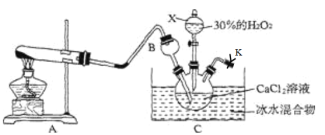
��1������X��������___���������װ�������Եķ���Ϊ��____
��2������B��������_______��CaO2�ĵ���ʽΪ______
��3��д��A�з�����Ӧ�Ļ�ѧ����ʽ��______��
��4����ȡCaO2��8H2Oʱ����ˮԡά�ַ�Ӧ��0��5��ĵ����½��У�ԭ����____������CaO2��8H2O�Ļ�ѧ����Ϊ____��
��5��2.76 gCaO2��8H2O��Ʒ������ˮ���̵���������(��Ʒ�������¶ȱ仯�����ߣ�140��ʱ��ȫ��ˮ���������Ȳ��ֽ�)��ͼ��ʾ��
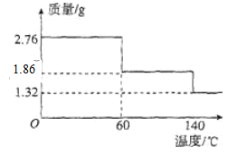
����ȷ��60��ʱCaO2��xH2O��x=______��
�ڸ���Ʒ��CaO2����������Ϊ______������4λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com