
【题目】(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两极各滴入几滴酚酞试液,则:

①电解池中X极上的电极反应式是:_________,在X极附近观察到的现象____________
②Y电极上的电极反应式是:__________________,总反应化学方程式是:_____。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是____。CuSO4溶液的浓度 ____(填“增大”、“减小”或“不变”)。
【答案】2H++2e-=H2↑,放出气体,溶液变红2Cl--2e-=Cl2↑2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑精铜不变
2NaOH+H2↑+Cl2↑精铜不变
【解析】
(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,电池反应式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极。
(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
因此,本题正确答案是:2H++2e-=H2↑;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑;电解时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,所以电池反应式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
因此,本题正确答案是:2Cl--2e-=Cl2↑;2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(2)电解方法精炼粗铜,电解池的阴极材料是精铜,X电极的材料是精铜;Y为阳极,阳极上粗铜失电子生成铜离子,其电极反应为Cu-2e-=Cu2+,硫酸铜溶液的浓度基本不变;
因此,本题正确答案是:精铜 ;不变。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
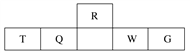
A. 离子半径:T<W<G
B. 等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C. 最简单气态氢化物的热稳定性:Q<R
D. T和G组成的化合物溶于水,其水溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米科技从本世纪初开始成为产业,为世人所瞩目,这是因为纳米粒子的直径在1纳米到100纳米之间,由纳米材料作为分散质的分散系具有的性质是( )
A.能通过滤纸,属最稳定的分散系B.属于介稳体系
C.有丁达尔效应,没有布朗运动D.一定能发生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下

已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L形成氢氧化物沉淀的pH范围如下:

③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为__________________。
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为_________、氯化铵与锰矿粉的质量之比为_________、焙烧时间为_________。

(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中c(Ca2+)/c(Mg2+)=_________。
(3)碳化结晶时,反应的离子方程式为__________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:甲:![]() 乙:
乙:![]() 其中能表明甲、乙容器中反应都达到平衡状态的是
其中能表明甲、乙容器中反应都达到平衡状态的是
A. 恒温时,气体压强不再改变
B. 断裂氢氧键速率是断裂氢氢键速率的2倍
C. 混合气体密度不变
D. 单位时间内,消耗水蒸气质量与生产氢气质量比为9:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的说法中正确的是( )
A.不能发生丁达尔效应的分散系有氯化钠溶液、水等
B.胶体的分散质粒子的直径为1nm~10nm
C.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康的危害更大
D.氯化铁溶液与氢氧化铁胶体的本质区别是有无丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子为AZX,9.5g该元素的氯化物XCl2配成溶液后,需用200mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。
(1)据此请计算出A值______________,
(2)写出该元素符号并确定其在周期性表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学教材中元素周期表的一部分,其中标出A~R15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
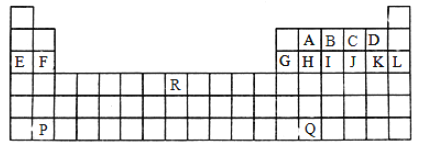
(1)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是_____,第三周期元素形成的简单离子中半径最小的是______。
(2)C与E可形成一种具有漂白性的物质,它含有的化学键为_____。
(3)Q在元素周期表中的位置是____,B、C可形成化合物B2C,该化合物的核外电子总数为____。
(4)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:_____。
(5)元素E与元素F相比,金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com