
【题目】某元素的原子为AZX,9.5g该元素的氯化物XCl2配成溶液后,需用200mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。
(1)据此请计算出A值______________,
(2)写出该元素符号并确定其在周期性表中的位置______________。
【答案】24 第三周期第ⅡA族
【解析】
根据反应Ag++Cl-=AgCl↓计算氯化物的相对分子质量,进而计算X的相对原子质量,根据中子数可计算X的质子数,可确定在周期表中的位置。
(1)n(AgNO3)=0.2L×1mol/L=0.2mol,根据反应Ag++Cl-=AgCl↓可知,n(Cl-)=n(Ag+)=0.2mol,则n(XCl2)=![]() ×n(Cl-)=0.1mol,M(XCl2)=
×n(Cl-)=0.1mol,M(XCl2)=![]() =95g/mol,所以X的质量数为95-2×35.5=24;
=95g/mol,所以X的质量数为95-2×35.5=24;
(2)X元素核内质子数和中子数相等,则质子数为24![]() =12,为Mg元素,原子核外有3个电子层,最外层电子数为2,位于周期表第三周期,第ⅡA族。
=12,为Mg元素,原子核外有3个电子层,最外层电子数为2,位于周期表第三周期,第ⅡA族。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )

A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两极各滴入几滴酚酞试液,则:

①电解池中X极上的电极反应式是:_________,在X极附近观察到的现象____________
②Y电极上的电极反应式是:__________________,总反应化学方程式是:_____。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是____。CuSO4溶液的浓度 ____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
I.已知:硫酸氢钠在水中的电离方程式为___________________________
(1)常温下,pH=5的硫酸氢钠溶液中水的电离程度______pH=9的一水合氨中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的硫酸氢钠与氨水混合后,溶液呈酸性的原因为______。(用离子方程式表示);若一定量的硫酸氢钠溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)___2c(SO42-)(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的PH_____7(填“>”、”=”或“<”)
II.25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:_______________________;(填编号)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中,c(CH3COO-)-c(Na+)=_____________。(填准确数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间反应后没有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀H2SO4反应后再加入足量的H2O2 ③Fe与过量的盐酸反应 ④Fe在足量的氧气中燃烧
A.只有①B.只有①②C.只有③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。

下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3kJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
A. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-98.3kJ·mol-1
SO3(g) ΔH=-98.3kJ·mol-1
B. 2SO2(g)+O2(g) ![]() 2SO3(l) ΔH=-196.6kJ·mol-1
2SO3(l) ΔH=-196.6kJ·mol-1
C. SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-78.64kJ·mol-1
SO3(g) ΔH=-78.64kJ·mol-1
D. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=+196.6kJ·mol-1
2SO3(g) ΔH=+196.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
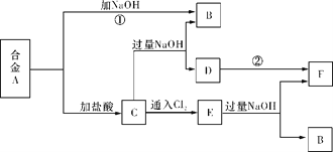
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com