
【题目】下列物质间反应后没有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀H2SO4反应后再加入足量的H2O2 ③Fe与过量的盐酸反应 ④Fe在足量的氧气中燃烧
A.只有①B.只有①②C.只有③D.①②③④
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③ 和
和
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
属于同系物的是________ 属于同分异构体的是_____属于同种物质的是________
(2)下列反应中,属于吸热反应的是__________.
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应.
(3)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(4)已知:2H2(g)+O2(g)=2H2O(g) △H=-483 kJ·mol -1N2(g)+2O2(g)=2NO2(g) △H=+68kJ·mol -1则H2还原NO2生成水蒸气的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下

已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L形成氢氧化物沉淀的pH范围如下:

③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为__________________。
分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为_________、氯化铵与锰矿粉的质量之比为_________、焙烧时间为_________。

(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中c(Ca2+)/c(Mg2+)=_________。
(3)碳化结晶时,反应的离子方程式为__________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的说法中正确的是( )
A.不能发生丁达尔效应的分散系有氯化钠溶液、水等
B.胶体的分散质粒子的直径为1nm~10nm
C.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康的危害更大
D.氯化铁溶液与氢氧化铁胶体的本质区别是有无丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子为AZX,9.5g该元素的氯化物XCl2配成溶液后,需用200mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。
(1)据此请计算出A值______________,
(2)写出该元素符号并确定其在周期性表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学教材中元素周期表的一部分,其中标出A~R15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
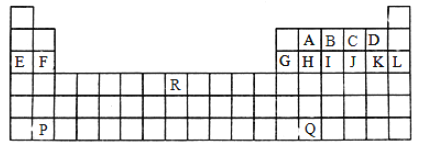
(1)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是_____,第三周期元素形成的简单离子中半径最小的是______。
(2)C与E可形成一种具有漂白性的物质,它含有的化学键为_____。
(3)Q在元素周期表中的位置是____,B、C可形成化合物B2C,该化合物的核外电子总数为____。
(4)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:_____。
(5)元素E与元素F相比,金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铁、铜和稀硫酸组成的原电池,所发生的总反应的离子方程式是
A. Fe-2e-=Fe2+ B. Cu2++2e-=Cu
C. 2H++2e-=H2↑ D. Fe+2H+=Fe2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com