
����Ŀ���Ȼ�隣������̿��Ʊ��ߴ���̼���̵Ĺ�����������

��֪�������̿����Ҫ�ɷ���MnCO3����������Fe��Al��Ca��Mg��Ԫ�ء�
����ؽ�������[c0(Mn+)=0.1mol/L�γ��������������pH��Χ���£�

�۳����£�CaF2��MgF2���ܶȻ��ֱ�Ϊ1.46��10��10��7.42��10��11��
�ش��������⣺
��1����������ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________________��
��������ͼ1��ͼ2��ͼ3���Ȼ�隣������̿����������ǣ������¶�Ϊ_________���Ȼ�����̿�۵�����֮��Ϊ_________������ʱ��Ϊ_________��

��2������Һ�������������������£����ȼ���MnO2��Fe2+����ΪFe3+����Ӧ�����ӷ���ʽΪ_________���ٵ�����Һ��pH��Al3+��Fe3+��Ϊ������ȥ����ҺpH�ķ�ΧΪ_________��Ȼ�����NH4F��Ca2+��Mg2+��ΪCaF2��MgF2������ȥ�����ֳ�������ʱ��Һ��c(Ca2+)/c(Mg2+)=_________��
��3��̼���ᾧʱ����Ӧ�����ӷ���ʽΪ__________________��
��4�����Ƶõĸߴ���̼�������ڹ���ϡ������ö��Ե缫��⣬��ij���õ���Ҫ�������ܲ���MnO2���õ缫�ĵ缫��ӦʽΪ__________________��
���𰸡�MnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O 500�� 1.10 60min MnO2��2Fe2����4H��=Mn2����2Fe3����2H2O 5.2��pH<8.8 1.97 Mn2����2HCO3��
MnCl2��2NH3����CO2����H2O 500�� 1.10 60min MnO2��2Fe2����4H��=Mn2����2Fe3����2H2O 5.2��pH<8.8 1.97 Mn2����2HCO3��![]() MnCO3��CO2����H2O Mn2����2H2O��2e��=MnO2��4H��
MnCO3��CO2����H2O Mn2����2H2O��2e��=MnO2��4H��
��������
��1��NH4Cl�ֽ�ΪNH3��HCl��HCl��MnCO3��Ӧ�õ�MnCl2��CO2��H2O���ɴ�д������ʽ��
��ͼ1��ͼ2��ͼ3���̽�����ѡ�����������
��2��MnO2�����������½�Fe2������ΪFe3����
��ʹAl3+��Fe3+��Ϊ������ȥ����ҺpH��5.2����ʹMn2+������pH<8.8���Ӷ�ȷ��pH��Χ��
��ƽ�ⳣ���������ֳ�������ʱ��Һ��![]() ��
��
��3��̼���ᾧʱ���ɿ���Mn��HCO3��2���ȷֽ⣬���д�����ӷ��̡�
��4�������õ���Ҫ�������ܲ���MnO2��ʧ���ӷ���������Ӧ��
��1��NH4Cl�ֽ�ΪNH3��HCl��HCl��MnCO3��Ӧ�õ�MnCl2��CO2��H2O����Ӧ����ʽΪMnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O��
MnCl2��2NH3����CO2����H2O��
�Ȼ�隣������̿����������ǣ������¶�Ϊ500�����Ȼ�����̿�۵�����֮��Ϊ1.10������ʱ��Ϊ60min��
��2��MnO2�����������½�Fe2������ΪFe3�������ӷ���ʽΪ��MnO2��2Fe2����4H��=Mn2����2Fe3����2H2O��
��ʹAl3+��Fe3+��Ϊ������ȥ����ҺpH��5.2����ʹMn2+������pH<8.8,��ҺpH�ķ�ΧΪ5.2��pH<8.8��
����NH4F��Ca2+��Mg2+��ΪCaF2��MgF2������ȥ�����ֳ�������ʱ��Һ��![]() =1.46��10��10/7.42��10��11=1.97.
=1.46��10��10/7.42��10��11=1.97.
��3���ɿ���Mn��HCO3��2���ȷֽ⣬���ӷ���ʽΪ��Mn2����2HCO3��![]() MnCO3��CO2����H2O��
MnCO3��CO2����H2O��
��4�� ���Ƶõĸߴ���̼�������ڹ���ϡ������ö��Ե缫��⣬�������õ���Ҫ�������ܲ���MnO2���õ缫�ĵ缫��ӦʽΪMn2����2H2O��2e��=MnO2��4H����������ӦΪ��2H����2e��=H2����


 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҺX�п��ܺ���K����Mg2����Al3����AlO��SiO��CO��SO��SO�е����������ӡ�ijͬѧ�Ը���Һ����������ʵ�飺

�����ж���ȷ����( )
A. �����һ���Ǵ����� B. �������ǹ������þ�Ļ����
C. K����AlO��SiOһ����������ҺX�� D. CO��SOһ������������ҺX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���������Ԫ�صĻ��ϼ�Ϊ+5�۵���
A. HCl B. NaClO C. KClO3 D. HClO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ��̶�Ϊa L���ܱ������г���1 mol X�����2 mol Y���壬������ӦX(g)��2Y(g) ![]() 2Z(g)���˷�Ӧ�ﵽƽ��״̬�ı�־��(����)
2Z(g)���˷�Ӧ�ﵽƽ��״̬�ı�־��(����)
A. �����������ܶȲ���ʱ��仯 B. �����ڸ����ʵ�Ũ�Ȳ���ʱ��仯
C. ������X��Y��Z��Ũ��֮��Ϊ1��2��2 D. ��λʱ��������0.1 mol X��ͬʱ����0.2 mol Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ִ�������ԭ��������������������ʾ��Ԫ����������Ԫ�����ڱ��е�λ���������
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
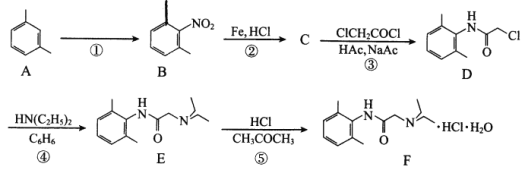
����Ŀ�����������(F)�����ڼ����ļ������������粫�������Ķ����٣��ϳ�·�����£�
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_________��
��2����Ӧ�������Լ��������ֱ�Ϊ_________��_________��
��3��B��ͬ���칹������ܶ࣬��������������B��ͬ���칹�干��_________��(�����������칹)�����й����ŵ�������_________��
�����ڱ�������������Ϲ�������ȡ������
����̼��������Һ��Ӧ�ɷų�CO2���塣
��4��C�Ľṹ��ʽΪ_________��
��5���ڷ�Ӧ��~��������ȡ����Ӧ����_________��
��6��ClCH2COCl������NaOH��Һ���ȳ�ַ�Ӧ�Ļ�ѧ����ʽΪ_________��
��7��NH(C2H5)2�ں˴Ź�����������_________��壬�������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����������뼸�η�̪��Һ����

�ٵ�����X���ϵĵ缫��Ӧʽ�ǣ�_________����X�������۲쵽������____________
��Y�缫�ϵĵ缫��Ӧʽ�ǣ�__________________���ܷ�Ӧ��ѧ����ʽ�ǣ�_____��
��2�� ��Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ��X�缫�IJ�����____��CuSO4��Һ��Ũ�� ____�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ䷴Ӧ��û�У�3�������ɵ��ǣ� ��
�ٹ�����Fe��Cl2��Ӧ ��Fe�����ϡH2SO4��Ӧ���ټ���������H2O2 ��Fe����������ᷴӦ ��Fe��������������ȼ��
A.ֻ�Т�B.ֻ�Т٢�C.ֻ�Т�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�
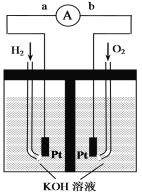
(1)����ȼ�ϵ�ص�����ת����Ҫ��ʽ��_______���ڵ����е�����������Ϊ____(��a��b��ʾ)��
(2)������ӦʽΪ_________________________��
(3)�缫����Ʋ��۵�ԭ��Ϊ______________________��
(4)�õ�ع���ʱ��H2��O2�������ⲿ��������ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
��2Li��H2![]() 2LiH
2LiH
II��LiH��H2O =LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����___����ӦII�е������� ��_____��
����֪LiH�����ܶ�Ϊ0.82 g/cm3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ________��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80����������ͨ�����ӵ����ʵ���Ϊ_________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com