
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )

A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
【答案】B
【解析】
由短周期元素在周期表的位置可知,A为第二周期元素,A元素原子的最外层电子数比其电子层数的3倍还多,A的电子层数为2,最外层电子数为7,A应为F元素,则X为O元素,M为Ne元素,Y为S元素,Z为Cl元素,N为Ar元素,结合元素对应的单质、化合物的性质以及元素周期律的递变规律解答该题。
由上述分析可知,X为O,A为F,M为Ne,Y为S,Z为Cl,N为Ar,则
A.氧元素的单质不能燃烧,为助燃剂,A错误;
B.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则X、Y、Z三种元素中S元素形成的单核阴离子半径最大,B正确;
C.O、F无正价,最高价氧化物对应的水化物酸性最强的是Cl元素,C错误;
D.氟气通入NaCl溶液中,F2与水反应生成HF与O2,不能置换出氯,不能证明F、Cl非金属性的相对强弱,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 电解精炼铜,当外电路通过NA个电子时,阳极质量减小32 g
B. 反应3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
C. 常温常压下27克Al与33.6L氯气完全反应,电子转移数小于3NA
D. 1 mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
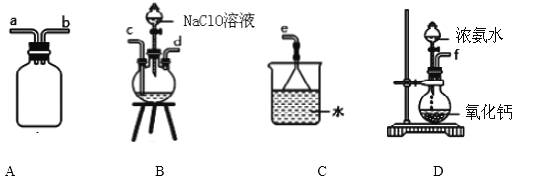
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开链烷烃的分子通式为CnH2n+2(n为正整数),分子中每减少2个碳氢键必然同时增加1个碳碳键,可能形成双键或三键也可能是环状烃,但都称之为增加一个不饱和度。例如:CH3C≡CCH2CH=CH2其不饱和度为3。如图所示篮烷的结构,其分子式为_______,其不饱和度为______。
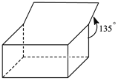
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaC1)的纯度,设计如下装置(含试剂)进行实验。

下列说法不正确的是
A. 必须在②③间添加吸收HC1的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 反应后通入空气的作用是保证②中产生的气体完全转移到③中
D. 根据称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
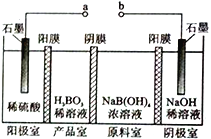
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒品冰毒属于芳香族化合物,分子中只含有碳、氢、氮三种元素,相对分子质量不超过150,碳元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为___________,分子式为___________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒的同分异构体的结构简式。(只要求写出其中的三种)。①苯环上只含有两个相邻的取代基②分子中含有氨基(—NH2)③分子中含有两个甲基(—CH3)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com