
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 电解精炼铜,当外电路通过NA个电子时,阳极质量减小32 g
B. 反应3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
C. 常温常压下27克Al与33.6L氯气完全反应,电子转移数小于3NA
D. 1 mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+的数目为NA
【答案】D
【解析】
A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质,故当转移NA个电子时,阳极减少的质量小于32g,故A错误;B.反应3H2(g)+N2(g)2NH3(g)ΔH=-92 kJ·mol-1,转移6mol电子,放出热量9.2kJ时,转移电子0.6NA,反应的N2标况下为2.24L,故B错误;C. 常温常压下与33.6L氯气的物质的量小于1.5mol, 所以与27克Al不能完全反应,故C错误;D. 氯正确化铜的化学式为CuCl2,n( Cu2+): n(Cl-)= 2:1,所以在1mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+的数目为NA,故D正确;答案:D。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是________。
(3)②③④中形成的简单离子半径由大到小的顺序是________。
(4)元素⑥氢化物常温下和元素②的单质反应的离子方程式是_____________,该氢化物与元素⑧的单质反应的离子方程式是_________________________ 。
(5)①和⑨的最高价氧化物对应的水化物化学式为________和________。①和⑨两元素形成化合物的化学式为________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为__________________。
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(7)⑥和⑧形成的化合物的化学式为________,该化合物溶解⑨的单质所得溶液为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物W的分子式为C9H12 ,其含有苯环的结构有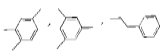 等,下列说法错误的是( )
等,下列说法错误的是( )
A. ![]() 与苯互为同系物
与苯互为同系物
B. 除了上述三种物质,W的含苯环的同分异构体还有5种
C. 有机物W的一种结构为![]() 该有机物不能与溴单质发生加成反应
该有机物不能与溴单质发生加成反应
D. 有机物W不管是否含有苯环,在一定条件下都能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3COONH4溶液呈中性,又知CH3COOH溶液加到NaHCO3溶液中有气体放出,试推断常温下NH4HCO3溶液的pH______7(填“>”、“<”或“=”)。
(2)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(3)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(4)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害。人体内生成的下列酸属于无机物的是
A. 乳酸(C3H6O3) B. 磷酸(H3PO4)
C. 丙酮酸(C3H4O3) D. 乙酰乙酸(C4H6O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )

A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com