
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
【答案】B
【解析】
A.由HCOOH 、HCN 的电离常数Ka=1.8×10-4、Ka=4.9×10-10,H2CO3的电离常数Ka1=4.3×10-7 、Ka2=5.6×10-11, 结合H+的能力:CO32->CN->HCO3->HCOO-,故A正确;B.根据电离平衡常数有CN-+H2O+CO2=HCN+HCO3-,故B错误;C.因为HCOOH比HCN酸性强,中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数K=c HCOO-)
HCN+ HCOO-的化学平衡常数K=c HCOO-)![]() c(HCN)/cHCOOH )
c(HCN)/cHCOOH )![]() c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。
c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。


科目:高中化学 来源: 题型:
【题目】将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况,忽略N2O4),则反应中消耗HNO3的物质的量为
A. 1molB. 0.05molC. 1.05molD. 0.11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。
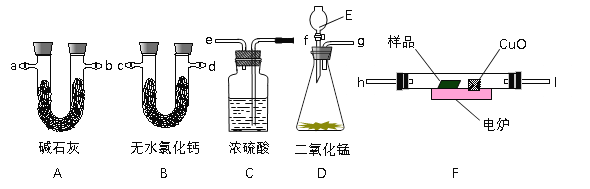
回答下列问题:
(1)用该方法可测定含有哪些元素和什么状态的有机物____________________________;
(2)A、B管内均盛有有固态试剂,B管的作用是_________________________________;
(3)产生的气体由左向右流向,所选用的各导管口连接的顺序是___________________;
(4)E中应盛装什么试剂:_____________________;
(5)如果把CuO网去掉,A管重量将_________;(填“增大”、“减小”、或“不变”)
(6)现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管增重1.76g,B管增重0.36g,则该有机物的的最简式为_______________;
(7)要确定该有机物的分子式,还必须知道的数据是_____________,可采用的现代物理方法有_________________;
(8)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A.烧碱、液态氧、碘酒B.干冰、铁、冰水混合物
C.生石灰、白磷、熟石灰D.碱石灰、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是 。
(3)该化合物的化学式(分子式)是 。
(4)该化合物分子中最多含 个![]() 官能团。
官能团。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 电解精炼铜,当外电路通过NA个电子时,阳极质量减小32 g
B. 反应3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出9.2 kJ热量时,反应的N2为2.24L
C. 常温常压下27克Al与33.6L氯气完全反应,电子转移数小于3NA
D. 1 mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
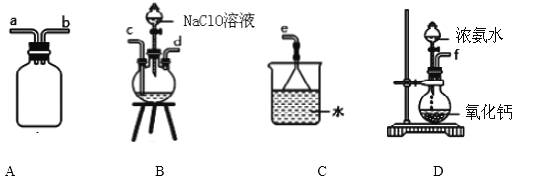
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com