
����Ŀ������( H3BO3) ΪһԪ���ᣬH3BO3����ͨ�����ķ����Ʊ����乤��ԭ������ͼ��ʾ( ��Ĥ����Ĥ�ֱ�ֻ���������ӡ�������ͨ��)������˵���������
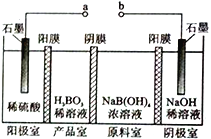
A. a ���Դ������������
B. �����ĵ缫��ӦʽΪ��2H2O-4e-=O2��+4H+
C. [B(OH)4]-������Ĥ�����Ʒ�ң�Na+������Ĥ����������
D. ����·��ͨ��3mol ����ʱ���ɵõ�1molH3BO3
���𰸡�D
��������A.�� a ��������ʯī����������Ϊ�����ң���a���Դ�����������ӣ���A��ȷ��B. �����Ϸ���������Ӧ����Һ��ˮʧȥ���������������缫��ӦʽΪ��2H2O-4e-=O2��+4H+������B��ȷ��C. �ڵ����У��������������˶����������������˶������[B(OH)4]-������Ĥ�����Ʒ�ң�Na+������Ĥ���������ң���C��ȷ��D. �����缫��ӦʽΪ��2H2O-4e-=O2��+4H+�������Ϸ�����ԭ��Ӧ����Һ�е�ˮ�õ���������������2H2O+2e- = H2��+ 2OH�D��[B(OH)4]-������Ĥ�����Ʒ�ң��������ӷ�Ӧ����H3BO3��[B(OH)4]-+ H+= H3BO3+ H2O������·��ͨ��3mol ����ʱ������3mol�����ӣ��ɵõ�3mol H3BO3����D����ѡD��


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȿ�����Ũ�������ֿ����ù����ʯ�Ҹ������( )
A.O2B.NH3C.Cl2D.SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��͵��ĵ��ʼ�һЩ�������ڹ�ũҵ��������������ҪӦ�á��ش��������⣺
(1)Nԭ�Ӻ�����__________�ֲ�ͬ�˶�״̬�ĵ��ӡ���̬Nԭ���У�������ߵĵ�����ռ�ݵ�ԭ�ӹ���ĵ����Ų�ʽΪ��__________
(2)���ⶨ����N2O5������NO2+��NO3-����������ɣ��ù�����N ԭ���ӻ����ͷֱ�Ϊ__________����NO2+��Ϊ�ȵ����������_______________ (д��һ��)��
(3)��δ��ȶ���NH4F��NH4I�У����ֽ����___________��ԭ����_____________________
(4)�ڶ������У���һ�����ܽ���BԪ�غ�NԪ�ؼ��Ԫ����__________�֡�
(5)�������ǵ������뵼����ϣ��侧��ṹ�͵��������ƣ������ṹ��ͼ��ʾ��
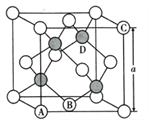
��ԭ����������DZ�ʾ�����ڲ���ԭ�ӵ����λ�ã�����ԭ���������AΪ(0,0,0 );BΪ(1/2,1/2,0) ;CΪ(1,0,1)����Dԭ�ӵ��������Ϊ____________________��
�ڼ�֪�����ؾ����ı߳�Ϊanm,���ܶ�Ϊdg/cm3����٤������NA=__________( ��a��d��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E ���ֶ�����Ԫ�أ�A��B��C��D��E �ֱ����Ԫ�ط����������ǵ�ԭ�������������� A ��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ����B Ԫ������������Ӧ��ˮ���������⻯�ﷴӦ����һ���� X��D �� A ͬ���������� E ͬ������E Ԫ��ԭ�ӵ�������������������������� 3/4 ����C �� E ͬ ���塣��ش��������⣺
��1��X �Ļ�ѧʽ_____��
��2�����и����У���˵��Ԫ�� C �� E �ǽ�����ǿ����ʵ��_____(�����).
�� �⻯��H2E�����Ա�H2Cǿ
�� �⻯��H2C�����ȶ��Ա�H2Eǿ
�� �⻯��H2E��ˮ��Һ�����ڿ����л�����
�� C �� E ��ɻ����C �Ը���
��3������ BC ��BC2��ɵĻ������ͨ����ͼ��ʾװ������������֤Ũ����������Ա�ϡ�����������ǿ��

��֪��i��Ũ�����ܽ����� BC ������BC2����ϡ��������� BC��
��ii��NaOH ��Һ��BC2��Ӧ�Ļ�ѧ����ʽΪ��2NaOH+2BC2�TNaBC2+NaBC+H2O��NaOH��Һ�� BC ���岻��Ӧ�� װ�â�������ʢ�ŵ�ҩƷ������_______��______________.
��4��ͨ��������֮ǰ��Ӧ��ͨ��һ��ʱ��ij����һ�����������Ʋ���ͨ��ĸ����������__________(�� һ������Ļ�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ȼ����й���������ȷ���ǣ� ��
A.�����������Ļ���������ȼ�
B.�������ȷ�Ӧ��������ұ�����۵�Ľ���
C.���ȼ����������ȷ�Ӧ��Ҫ��þ�����������ȼ���������ȷ�Ӧ�����ȷ�Ӧ
D.��ҵ�ϳ������ȷ�Ӧ������ұ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȿ���ͨ�������뵥�ʻ��ϣ�Ҳ����ͨ����Һ�еĸ��ֽⷴӦ���ƵõĻ������ǣ� ��
A.Na2O
B.Na2O2
C.FeCl2
D.FeS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������4�����ʣ���Na2O2����SiO2����SO2����NaHCO3���塣���У�
��1����ˮ��Ӧ��������ʹ������ľ����ȼ�Ĺ�����________������ţ���
��2����ʹƷ����Һ��ɫ�Ҽ���ʱ�ָ�ԭ����_________������ţ���
��3��������������1������������ˮ����������һ���������뽹̿������Ӧ�����Ƶõ���оƬ�Լ�̫���ܵ�صIJ������÷�Ӧ�Ļ�ѧ����ʽΪ��_______________________________��
��4��������������1�����ʿ���������ȥ�����θ�ᣬ�����dz��������ɼ�����Ҫ����Ϊ���ڼ��������²��������壬ʹʳƷ�����ɡ�д�������ȷֽ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���¡�����˵������ȷ���ǣ� ��

A. O2�ڵ缫b�Ϸ�����ԭ��Ӧ
B. ��Һ��OH����缫a�ƶ�
C. ��Ӧ���ĵ�NH3��O2�����ʵ���֮��Ϊ4��5
D. �����ĵ缫��ӦʽΪ2NH3��6e����6OH��===N2��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ Na2SO3�������� 250 mL 0.1000 mol��L��1 ��Һ�IJ�������ͼ����ش�
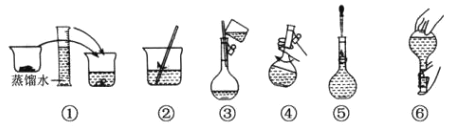
��1�������ƹ����б�Ҫ�������У��ձ�������������ͷ�ιܡ� 250ml ����ƿ��____________����������ƿ�Ƿ�©ˮ�IJ���������____________________________________��
��2�����в�������������Na2SO3��ҺŨ�Ȳ���������__________��
A������ƿ��������ˮϴ����û�к��
B��ͼ��û��������ˮϴ�ձ� 2-3 �Σ���ת��ϴҺ
C.ͼ��ʱ��������ƿ�Ŀ̶���
D.ͼ������Һ���Ե��ڿ̶��ߣ��ٵμ�����ˮʹҺ�氼����̶�������
��3����֪���������ڿ������ܱ������������������ƣ������ʵ��������Ƶ� Na2SO3 ��Һ�Ƿ�������_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com