
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
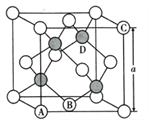
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
【答案】 7 2p3 sp、sp2 SCN-、CO2、 CS2、N3- 等中的任一种 NH4F F的电负性更大, F原子半径比I原子小,H-F键比H-I键强(H-F更易形成),F-更易夺取NH4+中的H 3 (3/4,3/4,3/ 4) NA=336/(a3d)×1021
【解析】(1). N是7号元素,核外电子排布式为1s22s22p3,则N原子核外有7种不同运动状态的电子,基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为2p3,故答案为:7;2p3;
(2). 经测定发现N2O5固体由NO2+和NO3-两种离子组成,NO2+的中心N原子价层电子对数为:2+![]() =2,杂化方式为sp,NO3-的中心N原子价层电子对数为:3+
=2,杂化方式为sp,NO3-的中心N原子价层电子对数为:3+![]() =3,杂化方式为sp2,NO2+所含的原子数为3、价电子数为16,根据等电子体原理,与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-等,故答案为:sp、sp2;SCN-、CO2、CS2、N3-等中的任一种;
=3,杂化方式为sp2,NO2+所含的原子数为3、价电子数为16,根据等电子体原理,与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-等,故答案为:sp、sp2;SCN-、CO2、CS2、N3-等中的任一种;
(3). NH4F受热分解生成NH3和HF,NH4I受热分解生成NH3和HI,因F原子半径比I原子小,且F元素的电负性更大,H-F键比H-I键更易形成,F-更易夺取NH4+中的H原子,所以NH4F更易分解,故答案为:NH4F;F的电负性更大,F原子半径比I原子小,H-F键比H-I键强(H-F更易形成),F-更易夺取NH4+中的H;
(4). 同一周期从左至右,元素的第一电离能呈增大趋势,因B元素的s能级为全充满的稳定状态,N元素的p能级为半充满的稳定状态,二种元素的第一电离能高于同周期相邻元素的第一电离能,则第一电离能介于B元素和N元素之间的有Be、C、O三种元素,故答案为:3;
(5).①.原子坐标参数:A为(0,0,0)、B为(1/2,1/2,0)、C为(1,0,1),由晶胞示意图可知,D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,由立体几何知识可知,D原子的坐标参数为(3/4,3/4,3/4),故答案为:(3/4,3/4,3/4);
②. 由晶胞示意图可知,Ga位于顶点和面心,N位于体内,根据均摊法,在一个晶胞中,含有Ga的个数为8×1/8+6×1/2=4,含有N的个数为4,氮化镓晶胞的边长为anm,则晶胞密度![]() =
=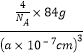 = dg/cm3,NA=
= dg/cm3,NA=![]() ×1021,故答案为:
×1021,故答案为:![]() ×1021。
×1021。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红、淡黄、蓝色、浅绿色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②铁与足量的稀硫酸反应 ③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中.
A.②③①④
B.③②①④
C.③①②④
D.③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)己知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
写出甲醇燃烧热的热化学方程式:___________________________________________________
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g) +3H2(g)
CO(g) +3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则p1__________p2(填“<”、“>”、“=”)
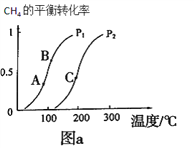
②A、B、C三点处对应平衡常数(KA、KB、KC) 的由大到小顺序为_______________。
③100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:__________。
A.容器内气体密度恒定 B.单位时间内消耗0.1mol CH4同时生成0.3molH2
C.容器的压强恒定 D.3v正(CH4)=v逆(H2)
(3)某实验小组利用CH3OH (g)、O2 (g)、KOH (aq) 设计成燃料电池,负极的电极反应式为:_____________________________,该电池工作时,溶液的pH将__________(填“增大”“减小”“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素 W、X、Y、Z,原子序数依次增大,请回答下列问题。
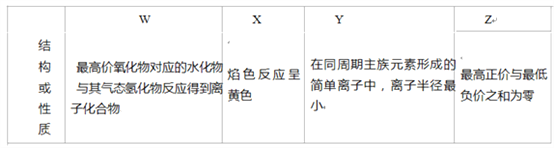
(1)Z 在元素周期表中位于_____族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学 反应,该元素是_____(填元素符号).
(3)① 下列可作为比较 X 和 Y 金属性强弱的依据是_____(填序号).
a.自然界中的含量 b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d.最高价氧化物对应水化物的碱性
② 从原子结构的角度解释 X 的金属性强于 Y 的原因:_____,原子半径 X>Y,所以原子核 对最外层电子的吸引力 X失电子能力 X>Y.
(4)W 的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与 X 的最高 价氧化物对应的水化物混合,反应的化学方程式是_____。
(5)Y 单质和 Mg 组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中 Y 的质量分数的数据有_____(填序号).
a. m、n b. m、y c. n、y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
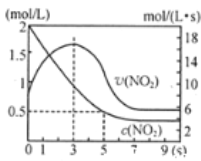
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位是ppm):

下列关于该有机物的叙述正确的是 ( )
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
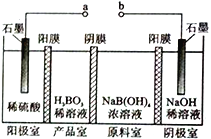
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确的是
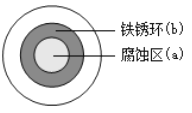
A. 铁片腐蚀过程发生的总化学方程式为:4Fe+6H2O+3O2 ==4 Fe(OH)3
B. 液滴之下氧气含量少, 铁片作负极,发生的氧化反应为: Fe-3e-=Fe3+
C. 液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH-
D. 铁片腐蚀最严重区域不是生锈最多的区域
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com