
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
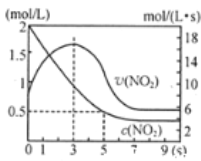
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。
【答案】 ![]() N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol NH3-5e-+5OH-=NO+4H2O > 12.5 容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 75%
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol NH3-5e-+5OH-=NO+4H2O > 12.5 容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 75%
【解析】(1)两个氮原子形成一个氮气分子,故用电子式表示氮气的形成过程为![]() 正确答案:;
正确答案:;![]() 。
。
(2)肼的燃烧反应为:![]() (g)
(g)![]() ;
; ![]() ,故可以知道热化学方程式为: ①
,故可以知道热化学方程式为: ①![]() ;而②
;而②![]() ;将①-②
;将①-②![]() 可以知道: N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mo;正确答案:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol 。
可以知道: N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mo;正确答案:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol 。
(3)氨的催化氧化用于工业生产硝酸,在此反应中氨气被氧化为NO在负极放电,结合环境为碱性可以知道电极反应为: NH3-5e-+5OH-=NO+4H2O;正确答案: NH3-5e-+5OH-=NO+4H2O。
(4) 已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11,碳酸根离子水解能力大于铵根离子水解能力,所以(NH4)2CO3溶液水解显碱性,c(OH-)>c(H+);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=c(HCO3-)×v(NH3·H2O)/c(NH4+)×c(CO32-)该式子分子分母同乘以c(OH-) 和c(H+),结果为KW/(K a2×Kb)=10-14/2×10-5×4×10-11=12.5;正确答案:> ; 12.5。
NH3·H2O+HCO3-的平衡常数K=c(HCO3-)×v(NH3·H2O)/c(NH4+)×c(CO32-)该式子分子分母同乘以c(OH-) 和c(H+),结果为KW/(K a2×Kb)=10-14/2×10-5×4×10-11=12.5;正确答案:> ; 12.5。
(5) ①反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,反应进行二氧化氮浓度减小,反应为达到平衡,![]() 时
时![]() 增大是因为体系温度升高,正确答案:容器为绝热体系,该反应正向进行放热,体系温度升高,
增大是因为体系温度升高,正确答案:容器为绝热体系,该反应正向进行放热,体系温度升高,![]() 增大。
增大。
②分析图象5s内二氧化氮变化浓度![]() ,结合转化率概念计算
,结合转化率概念计算 ,正确答案:
,正确答案:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有机物的分子式均为C8H10O

回答下则问题:
(1)上述物质中,能使酸性KMnO4溶液褪色的物质是_______(填字母)。
(2)D分子中共平面的碳原子有______个。
(3)C能使Br2的CCl4溶液褪色,该反应的反应类型属于_______________。
(4)已知:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
A | 176.7 | -32.1 | 不用于水,能与醇、醚等多种有机溶剂混溶 |
D | 217 | 61.5 | 溶于醇、醚、氯仿,微溶于水 |
①有A和D的混合物,可以通过_____(填实验操作名称)进行分离。
②有Na、Fe两种金属,其中实验室可以用来检验A和D的是____,写出可行的实验方案:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,则该电池在充电时,阳极的电极反应式_________________放电时负极反应的物质是__________________。
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是__________
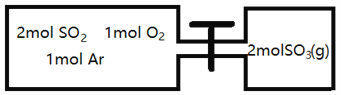
A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=__________
(4)室温下,0.1mol/LNaHCO3溶液的pH值__________0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)__________。(填“变大”、“变小”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
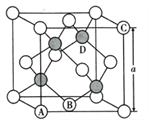
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 五种短周期元素(A、B、C、D、E 分别代表元素符号),它们的原子序数依次增大; A 是元素周期表中原子半径最小的元素;B 元素最高价氧化物对应的水化物与其氢化物反应生成一种盐 X;D 与 A 同主族,且与 E 同周期;E 元素原子的最外层电子数是其次外层电子数的 3/4 倍;C 与 E 同 主族。请回答下列问题:
(1)X 的化学式_____。
(2)下列各项中,能说明元素 C 比 E 非金属性强的事实有_____(填序号).
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
④ C 与 E 组成化合物,C 显负价
(3)将由 BC 和BC2组成的混合气体通入如图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(i)浓硝酸能将气体 BC 氧化成BC2,而稀硝酸不能氧化 BC。
(ii)NaOH 溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液与 BC 气体不反应。 装置②、③中盛放的药品依次是_______、______________.
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是__________(填 一种气体的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?________(填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计的原电池如图所示:

①负极材料是_______,发生的电极反应为____________________________;
②外电路中的电子是从________电极流向________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
Ⅱ.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①生成物的能量总和________(填“>”“<”或“=”)反应物的能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”“<”或“=”)572 kJ。
③每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。

a电极的电极反应式是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com