
【题目】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?________(填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计的原电池如图所示:

①负极材料是_______,发生的电极反应为____________________________;
②外电路中的电子是从________电极流向________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
Ⅱ.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①生成物的能量总和________(填“>”“<”或“=”)反应物的能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”“<”或“=”)572 kJ。
③每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。

a电极的电极反应式是_______________________________________________。
【答案】否 铜 Cu-2e-===Cu2+ 铜 银 0.05NA(或3.01×1022) 小于 < 143 kJ CH4-8e-+10OH-===CO32-+7H2O
【解析】
Ⅰ、(1)原电池的反应必须是自发的氧化还原反应,从理论上来讲,任何自发的氧化还原反应均可设计为原电池,非自发进行的氧化还原反应不能设计为原电池;(2)①由反应2Ag++Cu═Cu2++2Ag可知,在反应中,Cu被氧化,失电子,应为原电池的负极,反应式为Cu-2e-=Cu2+;②电子从负极Cu沿导线流向正极Ag;③当银电极质量增加5.4g,则n(Ag)=![]() =0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol;Ⅱ、(1)①氢气燃烧生成液态水时放热,则反应物的能量高于生成物的能量,故答案为:小于; ②液态水变为水蒸气是吸热的过程,2mol氢气燃烧生成液态水时放出572kJ热量,生成气态水时放出的热量小于572kJ,故答案为:<;③每克氢气燃烧生成液态水时放出的热量为
=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol;Ⅱ、(1)①氢气燃烧生成液态水时放热,则反应物的能量高于生成物的能量,故答案为:小于; ②液态水变为水蒸气是吸热的过程,2mol氢气燃烧生成液态水时放出572kJ热量,生成气态水时放出的热量小于572kJ,故答案为:<;③每克氢气燃烧生成液态水时放出的热量为![]() kJ=143 kJ;(2)a电极甲烷在碱性条件下失去电子产生碳酸根离子,反应的电极反应式是CH4-8e-+10OH-===CO32-+7H2O。
kJ=143 kJ;(2)a电极甲烷在碱性条件下失去电子产生碳酸根离子,反应的电极反应式是CH4-8e-+10OH-===CO32-+7H2O。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
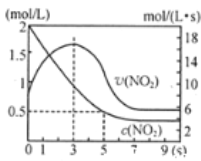
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
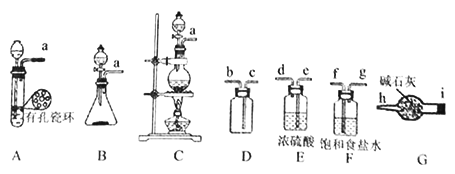
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的________(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为_____________。
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a→____→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):
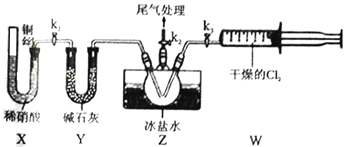
(3)实验室也可用B装置制备NO,与之相比X 装置的优点为__________________________。
(4)组装好实验装置后应先____________,然后依次装入药品、打开k2、再打开__________(填“k1”或“k3”),通入一段时间气体,其目的是为了排尽三颈烧瓶中的空气,防止NO、ClNO 变质。接下来,两种气体在Z中反应的现象为________________________________。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:AgCrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为_________________________。
(6)亚硝酰氯(ClNO)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A. ①②③④ B. ④⑤⑥⑦
C. ③⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确的是
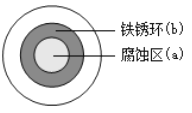
A. 铁片腐蚀过程发生的总化学方程式为:4Fe+6H2O+3O2 ==4 Fe(OH)3
B. 液滴之下氧气含量少, 铁片作负极,发生的氧化反应为: Fe-3e-=Fe3+
C. 液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH-
D. 铁片腐蚀最严重区域不是生锈最多的区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li和Na都是IA族元素,关于这两种元素的原子说法正确的是
A.原子半径:Li>NaB.核外电子数相同
C.核外电子层数相同D.最外层电子数都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com