
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
【答案】C
【解析】A项,键能:单键![]() 双键
双键![]() 三键,键能:C—N
三键,键能:C—N![]() C=N
C=N![]() C
C![]() N,A项正确;B项,原子半径:I
N,A项正确;B项,原子半径:I![]() Br
Br![]() Cl,键长:I—I
Cl,键长:I—I![]() Br—Br
Br—Br![]() Cl—Cl,B项正确;C项,H2O分子中O和NH3中N都采取不等性sp3杂化,H2O分子中O上有两对孤电子对,NH3分子中N上只有一对孤电子对,且电子对之间斥力大小顺序如下:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,分子中的键角:H2O
Cl—Cl,B项正确;C项,H2O分子中O和NH3中N都采取不等性sp3杂化,H2O分子中O上有两对孤电子对,NH3分子中N上只有一对孤电子对,且电子对之间斥力大小顺序如下:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,分子中的键角:H2O![]() NH3,H2O分子中键角为105,NH3分子中键角为107,C项错误;D项,σ键为“头碰头”重叠形成,强度大,π键为“肩并肩”重叠形成,强度小,乙烯分子中碳碳键的键能:σ键
NH3,H2O分子中键角为105,NH3分子中键角为107,C项错误;D项,σ键为“头碰头”重叠形成,强度大,π键为“肩并肩”重叠形成,强度小,乙烯分子中碳碳键的键能:σ键![]() π键,D项正确;答案选C。
π键,D项正确;答案选C。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 五种短周期元素(A、B、C、D、E 分别代表元素符号),它们的原子序数依次增大; A 是元素周期表中原子半径最小的元素;B 元素最高价氧化物对应的水化物与其氢化物反应生成一种盐 X;D 与 A 同主族,且与 E 同周期;E 元素原子的最外层电子数是其次外层电子数的 3/4 倍;C 与 E 同 主族。请回答下列问题:
(1)X 的化学式_____。
(2)下列各项中,能说明元素 C 比 E 非金属性强的事实有_____(填序号).
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
④ C 与 E 组成化合物,C 显负价
(3)将由 BC 和BC2组成的混合气体通入如图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(i)浓硝酸能将气体 BC 氧化成BC2,而稀硝酸不能氧化 BC。
(ii)NaOH 溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液与 BC 气体不反应。 装置②、③中盛放的药品依次是_______、______________.
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是__________(填 一种气体的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?________(填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计的原电池如图所示:

①负极材料是_______,发生的电极反应为____________________________;
②外电路中的电子是从________电极流向________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
Ⅱ.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①生成物的能量总和________(填“>”“<”或“=”)反应物的能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”“<”或“=”)572 kJ。
③每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。

a电极的电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氧气的反应情况受温度影响。某同学设计方案探究温度对产物影响的结果如图所示。下列说法不正确的是
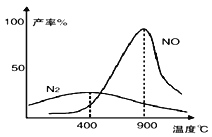
A. 温度较低时, 肼和氧气主要发生的反应N2H4+O2 = N2+2H2O
B. 900℃时,能发生 N2+O2 = 2NO
C. 900℃时, N2的产率与 NO 的产率之和可能小于 1
D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少煤炭燃烧过程 SO2 的排放,可采用固硫技术把 SO2 转化为 CaSO4的形式固定。已知:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)
2CO2(g) △H3=-566.0 kJ/mol (III)
(1)写出用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式____________。
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,请说明理由__________;在同一个图中画出反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图。_____________
(3)下列措施有助于反应(I)向逆反应方向移动的是__________。
A.升高温度 B.鼓入一定量 CO2 C.鼓入一定量 O2 D.加入负催化剂
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液, 以 Pt 为电极电解 NaHSO3溶液可制得硫酸。 请写出阳极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水 Na2SO3固体配制 250 mL 0.1000 mol·L-1 溶液的步骤如下图,请回答:
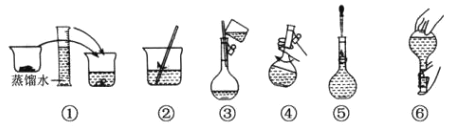
(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、 250ml 容量瓶和____________;检验容量瓶是否漏水的操作方法是____________________________________。
(2)下列操作不会对所配的Na2SO3溶液浓度产生误差的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
(3)已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠,请设计实验检验配制的 Na2SO3 溶液是否发生变质_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把标准状况下VL气体(摩尔质量为Mg·mol-1)溶于1L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为_________________mol/L;
(2)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________________
(3)一定质量的Al与足量盐酸反应,当转移了2 mol电子时,参与反应的铝的质量是________g。
(4)下列物质:①Fe ②NaCl ③Na2O ④CO ⑤CO2 ⑥蔗糖 ⑦NH3 ⑧NaCl溶液 ⑨盐酸 ⑩ H2SO4 Ba(OH)2
属于电解质的是_______ , 属于非电解质的是 ________,能导电的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73gHCl气体,计算:
(1)该气体为___ mol。
(2)该气体所含分子数为_________个。
(3)该气体在标准状况下的体积为___ L。
(4)将该气体溶于水配成2L溶液,其物质的量浓度为_______mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com