
【题目】为减少煤炭燃烧过程 SO2 的排放,可采用固硫技术把 SO2 转化为 CaSO4的形式固定。已知:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
CaS(s)+4CO2(g), △H2=-175.6 kJ/mol (Ⅱ)
2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)
2CO2(g) △H3=-566.0 kJ/mol (III)
(1)写出用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式____________。
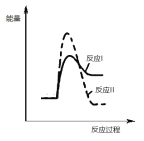
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,请说明理由__________;在同一个图中画出反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图。_____________
(3)下列措施有助于反应(I)向逆反应方向移动的是__________。
A.升高温度 B.鼓入一定量 CO2 C.鼓入一定量 O2 D.加入负催化剂
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液, 以 Pt 为电极电解 NaHSO3溶液可制得硫酸。 请写出阳极的电极反应式________________。
【答案】 2CaO(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s) △H3=-1002.8 kJ/mol 反应Ⅰ的活化能远小于反应Ⅱ的活化能
2CaSO4(s) △H3=-1002.8 kJ/mol 反应Ⅰ的活化能远小于反应Ⅱ的活化能 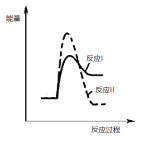 BC HSO3- - 2e- +H2O=SO42-+ 3H+
BC HSO3- - 2e- +H2O=SO42-+ 3H+
【解析】(1)已知:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ); 2CO(g)+O2
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol (Ⅰ); 2CO(g)+O2![]() 2CO2(g) △H3=-566.0 kJ/mol (III)。由盖斯定律可知,(III)- (Ⅰ)
2CO2(g) △H3=-566.0 kJ/mol (III)。由盖斯定律可知,(III)- (Ⅰ) ![]() 可得到用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式:2CaO(s)+2SO2(g)+O2(g)
可得到用 CaO(s)固硫转化为 CaSO4(s)的热化学方程式:2CaO(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s) △H3=-1002.8 kJ/mol。
2CaSO4(s) △H3=-1002.8 kJ/mol。
(2)煤炭燃烧过程中产生的 CO 与 CaSO4 反应, 降低脱硫效率。研究表明,在相同温度温度下,反应Ⅰ的速率远大于反应Ⅱ的速率,说明反应Ⅰ的活化分子百分数较高,其原因是:反应Ⅰ的活化能远小于反应Ⅱ的活化能;反应Ⅰ为吸热反应、反应Ⅱ为放热反应,反应Ⅰ和反应Ⅱ的反应过程与能量变化示意图如下:
(3)反应Ⅰ为气体分子数增大的吸热反应。下列措施A.升高温度,平衡右移;B.鼓入一定量 CO2 ,增大生成物浓度,平衡逆向移动;C.鼓入一定量 O2 有利于CO转化为CO2,平衡逆向移动;D.加入负催化剂,只能减小反应速率,平衡不移动。综上所述,有助于反应(I)向逆反应方向移动的是BC。
(4)用 NaOH 溶液吸收足量的 SO2得到 NaHSO3 溶液,以 Pt 为电极电解 NaHSO3溶液可制得硫酸。由题意知,阳极上HSO3- 失去电子被氧化为SO42-,电极反应式HSO3- - 2e- +H2O=SO42-+ 3H+。


科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4 ②CH3CH2OH ③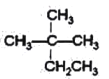 ④癸烷 ⑤CH3COOH ⑥
④癸烷 ⑤CH3COOH ⑥![]() ⑦
⑦![]() ⑧
⑧ ⑨丙烷
⑨丙烷
请利用上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃结构简式为_______
(2)分子中含有14个氢原子的烷烃的分子式是_____
(3)与③互为同分异构体的是________(填序号);
(4)具有特殊气味,常作萃取剂的有机物在铁作催化剂的条件下与液溴发生一溴代反应的化学方程式______
(5)⑦的所有同分异构体(不考虑空间异构)中一氯代物有3种的有____种。
(6)有机物②在加热条件下和CuO反应的化学方程式______
(7)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,所得反应前后气体的体积没有发生改变,则该烃是_____(填序号);它⑧与互为______关系;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A. ①②③④ B. ④⑤⑥⑦
C. ③⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li和Na都是IA族元素,关于这两种元素的原子说法正确的是
A.原子半径:Li>NaB.核外电子数相同
C.核外电子层数相同D.最外层电子数都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是
A.正极,被还原B.负极,被氧化
C.正极,被氧化D.负极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>C>D
B. 原子序数D>C>B>A
C. 离子半径C3->D->B+>A2+
D. 单质的还原性A>B,单质的氧化性C>D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com