
【题目】(1)把标准状况下VL气体(摩尔质量为Mg·mol-1)溶于1L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为_________________mol/L;
(2)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________________
(3)一定质量的Al与足量盐酸反应,当转移了2 mol电子时,参与反应的铝的质量是________g。
(4)下列物质:①Fe ②NaCl ③Na2O ④CO ⑤CO2 ⑥蔗糖 ⑦NH3 ⑧NaCl溶液 ⑨盐酸 ⑩ H2SO4 Ba(OH)2
属于电解质的是_______ , 属于非电解质的是 ________,能导电的是_____________。
【答案】![]() 0.28mol/L 18 ②③⑩ ④⑤⑥⑦ ①⑧⑨
0.28mol/L 18 ②③⑩ ④⑤⑥⑦ ①⑧⑨
【解析】
(1). 标准状况下VL气体的物质的量为:n=![]() =
=![]() mol,其质量为:m=
mol,其质量为:m=![]() mol×M g/mol=
mol×M g/mol=![]() g,1L水的质量约为1000g,所得溶液的质量为:(1000+
g,1L水的质量约为1000g,所得溶液的质量为:(1000+![]() )g,溶液的体积为:
)g,溶液的体积为:![]() =
=![]() L,则此溶液的物质的量浓度为:c=
L,则此溶液的物质的量浓度为:c=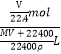 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(2). 把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量为n(Na+)=0.1L×0.3mol/L×2+0.4L×0.2mol/L=0.14mol,Na+的物质的量浓度为c(Na+)=0.14mol÷0.5L=0.28mol/L,故答案为:0.28mol/L;
(3). 1mol Al与足量盐酸反应生成氯化铝和氢气时,转移3mol电子,当转移2 mol电子时,参加反应的铝的物质的量为n(Al)=![]() mol,质量为m(Al)=
mol,质量为m(Al)=![]() mol×27g/mol=18g,故答案为:18;
mol×27g/mol=18g,故答案为:18;
(4). NaCl、H2SO4、Ba(OH)2在水溶液中可以电离出离子导电,Na2O在熔融状态下可以电离出离子导电,这四种物质属于电解质;CO、CO2、蔗糖、NH3在水溶液中或熔融状态下均不能电离出离子导电,这四种物质属于非电解质;Fe是金属单质,可以导电,NaCl溶液、盐酸中含有电解质电离出的离子,可以导电,故答案为:②③⑩ ;④⑤⑥⑦;①⑧⑨。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
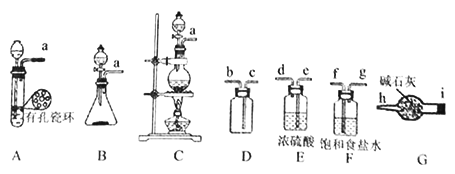
查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的________(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为_____________。
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a→____→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):
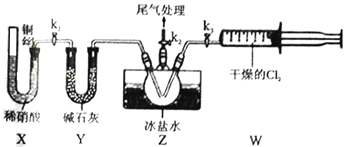
(3)实验室也可用B装置制备NO,与之相比X 装置的优点为__________________________。
(4)组装好实验装置后应先____________,然后依次装入药品、打开k2、再打开__________(填“k1”或“k3”),通入一段时间气体,其目的是为了排尽三颈烧瓶中的空气,防止NO、ClNO 变质。接下来,两种气体在Z中反应的现象为________________________________。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:AgCrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为_________________________。
(6)亚硝酰氯(ClNO)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>C>D
B. 原子序数D>C>B>A
C. 离子半径C3->D->B+>A2+
D. 单质的还原性A>B,单质的氧化性C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。

请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。①、④按原子个数比为1:1组成的分子的电子式____________________;由②、④两种元素组成的一种化合物的结构式________________;
(2)⑤⑥两种元素的原子半径由大到小的顺序是____________(填元素符号)。
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(4)元素③的气态氢化物和元素⑧的气态氢化物易于制备的是___________(填化学式)。
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月,中国对“可燃冰”试采成功。“可燃冰”是天然气水合物,被称为未来新能源。回答下列问题:
(1)用Cu2Al2O4作催化剂制备乙酸
已知:![]() ,各物质相对能量大小如图。
,各物质相对能量大小如图。
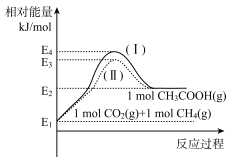
①a=____。
②反应物的活化分子浓度大小:过程I___ 过程Ⅱ(填“大于”、“小于”或“等于”)。
(2)甲烷超干催化重整(DRM)制备CO,在Ni、CaO及Fe3O4的共同催化作用下,可以获得极高浓度的CO,其机理如下:
第①步:Ni基催化![]()
第②步:Fe的还原![]()
第③步:CO2的捕获![]()
第④步:CO2的释放与还原![]()
设计第②步与第③步反应有利于实现氢物种与____的彻底分离,从勒夏特列原理的角度看,这也有利于____;过程①中,当投料比![]() = ___时,才能保持催化剂组成不变。
= ___时,才能保持催化剂组成不变。
(3)甲烷催化重整与压强的关系
已知:![]() ,现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2)的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 ___(填番号);求该温度条件下反应的平衡常数Kp=___ (计算表达式)。【已知:Kp是用分压力代替各物质的浓度计算的平衡常数,任一组分B的分压p(B)等于总压p乘以它的体积分数y(B)】
,现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2)的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 ___(填番号);求该温度条件下反应的平衡常数Kp=___ (计算表达式)。【已知:Kp是用分压力代替各物质的浓度计算的平衡常数,任一组分B的分压p(B)等于总压p乘以它的体积分数y(B)】
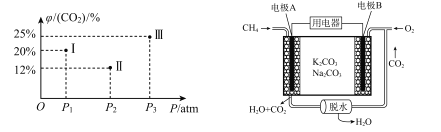
(4)甲烷用于燃料电池
已知:甲烷电池的工作原理如上有图,则负极反应方程式为 ___;当A极消耗标况下44.8 LCH4时,理论上B极转移电子的物质的量为 ___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com