
【题目】下表列出了①~⑨九种元素在周期表中的位置。

请按要求回答下列问题:
(1)元素⑦的原子结构示意图______________________。①、④按原子个数比为1:1组成的分子的电子式____________________;由②、④两种元素组成的一种化合物的结构式________________;
(2)⑤⑥两种元素的原子半径由大到小的顺序是____________(填元素符号)。
(3)⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较弱的是________(填化学式)。
(4)元素③的气态氢化物和元素⑧的气态氢化物易于制备的是___________(填化学式)。
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应水化物反应,其离子方程式为_________________________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式__________________ ;一种离子化合物的化学式_________。
【答案】![]()
![]() O=C=O Na>Mg H2SO4 H2S Al(OH)3+OH-=AlO2-+2H2O H2O Na2O
O=C=O Na>Mg H2SO4 H2S Al(OH)3+OH-=AlO2-+2H2O H2O Na2O
【解析】
根据元素在周期表中的位置知①②③④⑤⑥⑦⑧⑨分别是H、C、P、O、Na、Mg、Al、S、Cl元素。
(1) 元素⑦为Al,原子结构示意图为:![]() ;①、④按原子个数比为1:1组成的分子为:H2O2,电子式为:
;①、④按原子个数比为1:1组成的分子为:H2O2,电子式为:![]() ;由②、④两种元素组成的化合物为:CO2, 结构式为:O=C=O。答案为:
;由②、④两种元素组成的化合物为:CO2, 结构式为:O=C=O。答案为: 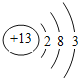 ;
;![]() ;O=C=O;
;O=C=O;
(2)Na与Mg均属于同种周期元素,由于核电核数Na![]() Mg,故半径Na
Mg,故半径Na![]() Mg,因此,答案为: Na>Mg;
Mg,因此,答案为: Na>Mg;
(3)因为非金属性Cl![]() S,故酸性:高氯酸大于硫酸,答案为: H2SO4 ;
S,故酸性:高氯酸大于硫酸,答案为: H2SO4 ;
(4)因为非金属性S>P,故H2S更易制备,因此,答案为: H2S;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,氢氧化铝难溶,不能拆,水为氧化物不能拆,离子反应方程式为: Al(OH)3+OH-=AlO2-+2H2O,答案为: Al(OH)3+OH-=AlO2-+2H2O;
(6)H、O和Na形成的共价化合物为水,离子化合物为过氧化钠、氧化钠、氢氧化钠等,答案为: H2O、Na2O


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无水 Na2SO3固体配制 250 mL 0.1000 mol·L-1 溶液的步骤如下图,请回答:
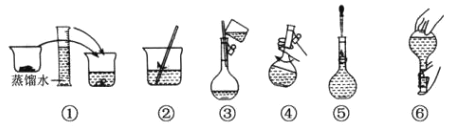
(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、 250ml 容量瓶和____________;检验容量瓶是否漏水的操作方法是____________________________________。
(2)下列操作不会对所配的Na2SO3溶液浓度产生误差的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
(3)已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠,请设计实验检验配制的 Na2SO3 溶液是否发生变质_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把标准状况下VL气体(摩尔质量为Mg·mol-1)溶于1L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为_________________mol/L;
(2)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________________
(3)一定质量的Al与足量盐酸反应,当转移了2 mol电子时,参与反应的铝的质量是________g。
(4)下列物质:①Fe ②NaCl ③Na2O ④CO ⑤CO2 ⑥蔗糖 ⑦NH3 ⑧NaCl溶液 ⑨盐酸 ⑩ H2SO4 Ba(OH)2
属于电解质的是_______ , 属于非电解质的是 ________,能导电的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基水杨胺(Z)可以治疗胆囊炎、胆管炎等。合成羟苯水杨胺的反应如下图,下列说法正确的是
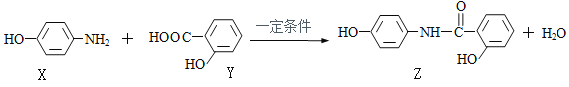
A. X能和NaHCO3溶液反应产生CO2
B. Z的分子式为C13H12O3N
C. X、Y、Z都能发生消去反应、取代反应、加成反应
D. Z在一定条件下与NaOH溶液发生反应时,1mol Z 最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
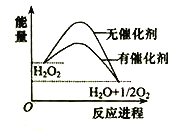
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73gHCl气体,计算:
(1)该气体为___ mol。
(2)该气体所含分子数为_________个。
(3)该气体在标准状况下的体积为___ L。
(4)将该气体溶于水配成2L溶液,其物质的量浓度为_______mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是

A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com