
【题目】光导纤维成为信息社会必不可少的高技术材料,下列物质用于制造光导纤维的是( )
A. 二氧化硅B. 大理石C. 铝合金D. 金刚石
科目:高中化学 来源: 题型:
【题目】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量。
(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意?________(填“是”或“否”)。
(2)乙同学依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计的原电池如图所示:

①负极材料是_______,发生的电极反应为____________________________;
②外电路中的电子是从________电极流向________电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应共转移的电子数目是________。
Ⅱ.水是生命之源,也是化学反应中的主角。请回答下列问题:
(1)已知:2 mol H2完全燃烧生成液态水时放出572 kJ的热量。
①生成物的能量总和________(填“>”“<”或“=”)反应物的能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”“<”或“=”)572 kJ。
③每克氢气燃烧生成液态水时放出的热量为________。
(2)天然气(主要成分CH4)和氧气反应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。

a电极的电极反应式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把标准状况下VL气体(摩尔质量为Mg·mol-1)溶于1L水中(不考虑反应),所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为_________________mol/L;
(2)把100mL0.3mol/LNa2SO4溶液和400mL0.2mol/LNaCl溶液混合后,溶液中Na+的物质的量浓度为_____________________
(3)一定质量的Al与足量盐酸反应,当转移了2 mol电子时,参与反应的铝的质量是________g。
(4)下列物质:①Fe ②NaCl ③Na2O ④CO ⑤CO2 ⑥蔗糖 ⑦NH3 ⑧NaCl溶液 ⑨盐酸 ⑩ H2SO4 Ba(OH)2
属于电解质的是_______ , 属于非电解质的是 ________,能导电的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
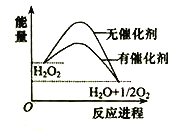
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73gHCl气体,计算:
(1)该气体为___ mol。
(2)该气体所含分子数为_________个。
(3)该气体在标准状况下的体积为___ L。
(4)将该气体溶于水配成2L溶液,其物质的量浓度为_______mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com