
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)己知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
写出甲醇燃烧热的热化学方程式:___________________________________________________
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g) +3H2(g)
CO(g) +3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则p1__________p2(填“<”、“>”、“=”)
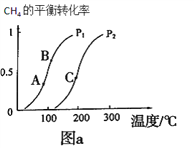
②A、B、C三点处对应平衡常数(KA、KB、KC) 的由大到小顺序为_______________。
③100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:__________。
A.容器内气体密度恒定 B.单位时间内消耗0.1mol CH4同时生成0.3molH2
C.容器的压强恒定 D.3v正(CH4)=v逆(H2)
(3)某实验小组利用CH3OH (g)、O2 (g)、KOH (aq) 设计成燃料电池,负极的电极反应式为:_____________________________,该电池工作时,溶液的pH将__________(填“增大”“减小”“不变”)
【答案】 2CH3OH(l)+3O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1 < KC>KB>KA CD CH3OH-6e-+8OH-=CO32-+6H2O 减小
【解析】(1). 已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1,②H2O(g)=H2O(l)△H3=-44.0kJ·mol-1,根据盖斯定律,(①+②×4)÷2得表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1;
(2). ①. CH4(g)+H2O(g)![]() CO(g)+3H2(g)为气体增多的可逆反应,增大压强,平衡逆向移动,CH4的转化率减小,由图a可知,相同温度下,压强为p1时的转化率大于p2时的转化率,则p1<p2,故答案为:<;
CO(g)+3H2(g)为气体增多的可逆反应,增大压强,平衡逆向移动,CH4的转化率减小,由图a可知,相同温度下,压强为p1时的转化率大于p2时的转化率,则p1<p2,故答案为:<;
②. 由图a可知,升高温度,CH4的转化率增大,说明CH4(g)+H2O(g)![]() CO(g)+3H2(g)的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,因温度TA<TB<TC,则平衡常数KC>KB>KA,故答案为:KC>KB>KA;
CO(g)+3H2(g)的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大,因温度TA<TB<TC,则平衡常数KC>KB>KA,故答案为:KC>KB>KA;
③. A.在恒温恒容的条件下发生反应CH4(g)+H2O(g)![]() CO(g)+3H2(g),容器内气体的密度始终不变,则容器内气体密度恒定,不能说明反应达到平衡状态,故A错误;B.单位时间内消耗0.1mol CH4的同时生成0.3molH2,表示的均为正反应速率,不能说明正反应速率和逆反应速率相等,不一定为平衡状态,故B错误;C.该反应为反应前后气体物质的量不相等的可逆反应,容器的压强恒定,说明反应达到平衡状态,故C正确;D. 当3v正(CH4)=v逆(H2)时,正反应速率等于逆反应速率,反应达到平衡状态,故D正确;答案为:CD;
CO(g)+3H2(g),容器内气体的密度始终不变,则容器内气体密度恒定,不能说明反应达到平衡状态,故A错误;B.单位时间内消耗0.1mol CH4的同时生成0.3molH2,表示的均为正反应速率,不能说明正反应速率和逆反应速率相等,不一定为平衡状态,故B错误;C.该反应为反应前后气体物质的量不相等的可逆反应,容器的压强恒定,说明反应达到平衡状态,故C正确;D. 当3v正(CH4)=v逆(H2)时,正反应速率等于逆反应速率,反应达到平衡状态,故D正确;答案为:CD;
(3). 利用CH3OH(g)、O2(g)、KOH(aq)设计成燃料电池,在负极上,甲醇失电子发生氧化反应,电极反应式为CH3OH-6e+8OH=CO32+6H2O,该电池的总反应式为2CH3OH+4OH+3O2=2CO32+6H2O,由总反应式可知,溶液中c(OH)减小,溶液的pH将减小,故答案为:CH3OH-6e+8OH=CO32+6H2O;减小。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,则该电池在充电时,阳极的电极反应式_________________放电时负极反应的物质是__________________。
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是__________
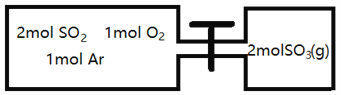
A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=__________
(4)室温下,0.1mol/LNaHCO3溶液的pH值__________0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)__________。(填“变大”、“变小”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
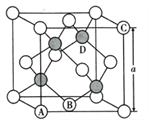
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 五种短周期元素(A、B、C、D、E 分别代表元素符号),它们的原子序数依次增大; A 是元素周期表中原子半径最小的元素;B 元素最高价氧化物对应的水化物与其氢化物反应生成一种盐 X;D 与 A 同主族,且与 E 同周期;E 元素原子的最外层电子数是其次外层电子数的 3/4 倍;C 与 E 同 主族。请回答下列问题:
(1)X 的化学式_____。
(2)下列各项中,能说明元素 C 比 E 非金属性强的事实有_____(填序号).
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
④ C 与 E 组成化合物,C 显负价
(3)将由 BC 和BC2组成的混合气体通入如图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(i)浓硝酸能将气体 BC 氧化成BC2,而稀硝酸不能氧化 BC。
(ii)NaOH 溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液与 BC 气体不反应。 装置②、③中盛放的药品依次是_______、______________.
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是__________(填 一种气体的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com