
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
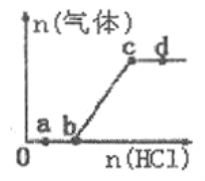
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取92g乙醇和60g乙酸反应,如果实际产率是理论产率的67%,则可得到乙酸乙脂的质量近似为是( )
A. 59g B. 88g C. 149.6g D. 176g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红、淡黄、蓝色、浅绿色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②铁与足量的稀硫酸反应 ③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中.
A.②③①④
B.③②①④
C.③①②④
D.③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)己知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
写出甲醇燃烧热的热化学方程式:___________________________________________________
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g) +3H2(g)
CO(g) +3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则p1__________p2(填“<”、“>”、“=”)
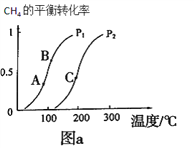
②A、B、C三点处对应平衡常数(KA、KB、KC) 的由大到小顺序为_______________。
③100℃时,将1molCH4和2molH2O通入容积为100L的反应室,反应达平衡的标志是:__________。
A.容器内气体密度恒定 B.单位时间内消耗0.1mol CH4同时生成0.3molH2
C.容器的压强恒定 D.3v正(CH4)=v逆(H2)
(3)某实验小组利用CH3OH (g)、O2 (g)、KOH (aq) 设计成燃料电池,负极的电极反应式为:_____________________________,该电池工作时,溶液的pH将__________(填“增大”“减小”“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素 W、X、Y、Z,原子序数依次增大,请回答下列问题。
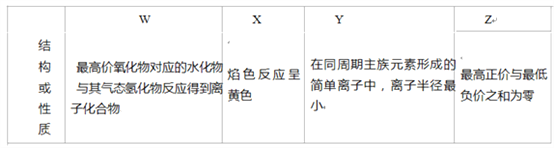
(1)Z 在元素周期表中位于_____族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学 反应,该元素是_____(填元素符号).
(3)① 下列可作为比较 X 和 Y 金属性强弱的依据是_____(填序号).
a.自然界中的含量 b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d.最高价氧化物对应水化物的碱性
② 从原子结构的角度解释 X 的金属性强于 Y 的原因:_____,原子半径 X>Y,所以原子核 对最外层电子的吸引力 X失电子能力 X>Y.
(4)W 的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与 X 的最高 价氧化物对应的水化物混合,反应的化学方程式是_____。
(5)Y 单质和 Mg 组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中 Y 的质量分数的数据有_____(填序号).
a. m、n b. m、y c. n、y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位是ppm):

下列关于该有机物的叙述正确的是 ( )
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
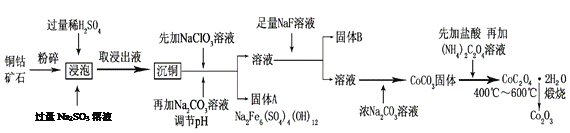
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
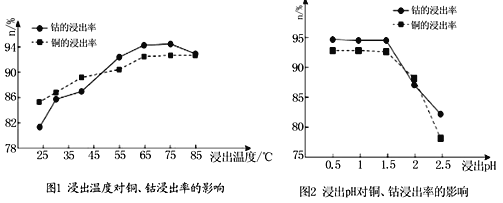
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
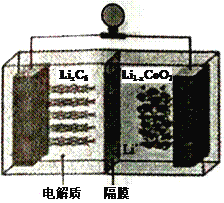
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com