
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
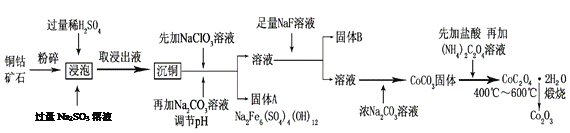
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
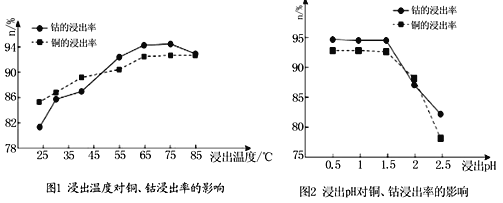
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
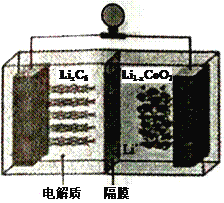
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
【答案】 1 Na2SO3 2 1 Na2SO4 3 H2O CaF2、MgF2 将Fe2+氧化为Fe3+,再沉淀分离 6 温度:65℃~75℃、pH:0.5~1.5 pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降 4 CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O 左 右 Li1-xCoO2+xLi++xe-= LiCoO2
2Co2O3+8CO2+8H2O 左 右 Li1-xCoO2+xLi++xe-= LiCoO2
【解析】(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,根据流程图和氧化还原反应的规律,反应中Co的化合价降低,则亚硫酸钠中S的化合价升高,配平后的方程式为2CoO(OH)+2H2SO4+ Na2SO3=CoSO4+ Na2SO4+3H2O,故答案为:Na2SO3;Na2SO4;3H2O;
(2)某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等,根据(1)的分析,浸出液中含有CoSO4、Na2SO4,以及硫酸铜、硫酸镁、硫酸亚铁和少量硫酸钙,经过沉铜后加入氯酸钠将亚铁离子氧化,调节pH沉淀铁离子,得到的溶液中加入氟化钠主要生成氟化钙和氟化镁沉淀,故答案为:CaF2、MgF2;
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是将Fe2+氧化为Fe3+,再沉淀分离;若上述流程中固、液分离均采用过滤操作,则共有6处使用了过滤,分别为浸泡后取浸出液、沉铜、调节pH沉铁、加入氟化钠沉淀钙离子和镁离子、加入浓碳酸钠沉钴、碳酸钴用盐酸溶解后加入草酸铵生成草酸钴沉淀,故答案为:将Fe2+氧化为Fe3+,再沉淀分离;6;
(4)①根据图像,矿石粉末浸泡时的浸出率最高的条件为:温度在65℃-75℃、pH在0.5-1.5,故答案为:温度:65℃-75℃、pH:0.5-1.5;
②根据图像,pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降,导致铜、钴浸出率下降,故答案为:pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降;
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3,钴元素的化合价升高,被空气中的氧气氧化,同时草酸根被氧化氧化生成二氧化碳和水,反应的化学方程式为4CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O,故答案为:4CoC2O4·2H2O+3O2
2Co2O3+8CO2+8H2O,故答案为:4CoC2O4·2H2O+3O2![]() 2Co2O3+8CO2+8H2O;
2Co2O3+8CO2+8H2O;
(6)根据电池反应式LixC6+Li1-xCoO2![]() C6 +LiCoO2知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以左侧是负极、右侧是正极。
C6 +LiCoO2知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,所以左侧是负极、右侧是正极。
①放电时,Li+由负极通过隔膜移向正极,即移动的方向为左→右,故答案为:左;右;
②放电时,正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,故答案为:Li1-xCoO2+xLi++xe-= LiCoO2。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝热剂的有关叙述中正确的是( )
A.氧化铝和铁的混合物是铝热剂
B.利用铝热反应,常用于冶炼高熔点的金属
C.铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应
D.工业上常用铝热反应来大量冶炼金属铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①Na2O2、②SiO2、③SO2、④NaHCO3固体。其中,
(1)与水反应,生成能使带火星木条复燃的固体是________(填序号);
(2)能使品红溶液褪色且加热时又复原的是_________(填序号);
(3)上述物质中有1种物质难溶于水,该物质在一定条件下与焦炭发生反应,可制得电脑芯片以及太阳能电池的材料,该反应的化学方程式为:_______________________________;
(4)上述物质中有1种物质可以用来除去多余的胃酸,它还是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变疏松。写出其受热分解的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A. 等于5s B. 等于10s C. 小于10s D. 大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸亚铁、硫酸铁和硫酸铜溶液中加入铁粉,充分反应后,滤出的不溶物除铜粉外,尚有少量铁粉,那么在滤液中( )
A.肯定有Fe2+ , 可能有Fe3+
B.只有Fe2+ , 没有Fe3+和Cu2+
C.可能有Fe3+ , 可能有Cu2+
D.肯定有Fe2+ , 可能有Fe3+、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氧气的反应情况受温度影响。某同学设计方案探究温度对产物影响的结果如图所示。下列说法不正确的是
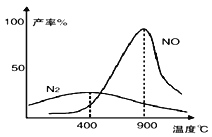
A. 温度较低时, 肼和氧气主要发生的反应N2H4+O2 = N2+2H2O
B. 900℃时,能发生 N2+O2 = 2NO
C. 900℃时, N2的产率与 NO 的产率之和可能小于 1
D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基水杨胺(Z)可以治疗胆囊炎、胆管炎等。合成羟苯水杨胺的反应如下图,下列说法正确的是
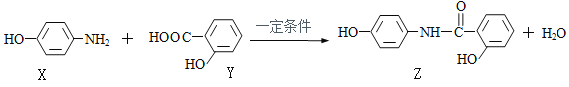
A. X能和NaHCO3溶液反应产生CO2
B. Z的分子式为C13H12O3N
C. X、Y、Z都能发生消去反应、取代反应、加成反应
D. Z在一定条件下与NaOH溶液发生反应时,1mol Z 最多消耗3 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com