
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。

下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
【答案】C
【解析】
A、由图可知纯的活性炭铜离子的浓度减小;
B、铁与活性炭形成原电池,铁比炭活泼;
C、由图可知纯铁时去除铜离子的速率,没铁碳比为2:1时的速率快;
D、利用铁碳混合物回收含Cu2+废水中铜的反应原理是铁与铜离子发生自发的氧化还原反应。
A项,活性炭具有许多细小微孔,且表面积巨大,具有很强的吸附能力,由图像可知,Cu2+在纯活性炭中浓度减小,表明活性炭对Cu2+具有一定的吸附作用,故不选A项;
B项,铁屑和活性炭在溶液中形成微电池,其中铁具有较强的还原性,易失去电子形成Fe2+,发生氧化反应,因此铁作负极,故不选B项;
C项,由图像可知,随着铁碳混合物中铁含量的增加至x=2:1,Cu2+的去除速率逐渐增加;但当铁碳混合物变为纯铁屑时,Cu2+的去除速率降低。当铁碳混合物中铁的含量过大时,正极材料比例降低,铁碳在废液中形成的微电池数量减少,Cu2+的去除速率会降低,因此增大铁碳混合物中铁碳比(x),不一定会提高废水中Cu2+的去除速率,故选C项;
D项,在铁碳微电池中,碳所在电极发生还原反应,Cu2+得到电子生成铜单质;因此该微电池的总反应方程式为Fe+Cu2+=Fe2++Cu,故不选D项。
综上所述,本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。

(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:甲:![]() 乙:
乙:![]() 其中能表明甲、乙容器中反应都达到平衡状态的是
其中能表明甲、乙容器中反应都达到平衡状态的是
A. 恒温时,气体压强不再改变
B. 断裂氢氧键速率是断裂氢氢键速率的2倍
C. 混合气体密度不变
D. 单位时间内,消耗水蒸气质量与生产氢气质量比为9:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子为AZX,9.5g该元素的氯化物XCl2配成溶液后,需用200mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。
(1)据此请计算出A值______________,
(2)写出该元素符号并确定其在周期性表中的位置______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH-CH2OH)可发生的化学反应( )
①加成反应 ②氧化反应 ③加聚反应 ④取代反应 ⑤置换反应
A.①②③B.①②④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学教材中元素周期表的一部分,其中标出A~R15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
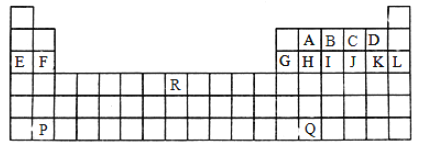
(1)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是_____,第三周期元素形成的简单离子中半径最小的是______。
(2)C与E可形成一种具有漂白性的物质,它含有的化学键为_____。
(3)Q在元素周期表中的位置是____,B、C可形成化合物B2C,该化合物的核外电子总数为____。
(4)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:_____。
(5)元素E与元素F相比,金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=akJ·mol-1
4N2(g)+6H2O(g) △H1=akJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) △H2=bkJ·mol-1
3N2(g)+6H2O(g) △H2=bkJ·mol-1
副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H4=dkJ·mol-1
4NO(g)+6H2O(g) △H4=dkJ·mol-1
可以计算出反应2NO(g)+O2(g)![]() 2NO2(g)的△H为( )
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大。A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是__________________。
(2)下列事实能用元素周期律解释的是_____(填字母序号)。
a . D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b. E的气态氢化物的稳定性小于HF
c. WE3的溶液可用于刻蚀铜制的印刷电路板
(3)E的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是__________。
(4)①工业上用电解法制备D的单质,反应的化学方程式为____________________。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
① 上述反应的离子方程式为__________。
② D的单质与X在高温下反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________(写化学式)
(2)基态Cr3+的核外电子排布式为_____________________。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________,C2O42-中碳原子的杂化轨道类型是___________,与H2O互为等电子体的离子是___________(任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________(填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________pm。
③阿伏加德罗常数的值为NA,该晶体密度的计算表达式为___________g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com