
����Ŀ����֪A��B��C��D��E��F�Ǻ���ͬһ��Ԫ�صĻ��������F����ʹʪ��ĺ�ɫʯ����ֽ���������壬A�� B������β������Ҫ�ɷ֣�����֮���ܷ������·�Ӧ��
��![]() ��
��
��![]()
![]() ����
����![]() ��
��
��![]()
(1)д�����ǵĻ�ѧʽ��A______��C______��D______��F______��
(2)д��![]() ��Ӧ�Ļ�ѧ����ʽ������Ҫ����գ�_______________________________�������Ӧ______
��Ӧ�Ļ�ѧ����ʽ������Ҫ����գ�_______________________________�������Ӧ______![]() ����������������������
����������������������![]() ������ԭ��Ӧ��
������ԭ��Ӧ��
(3)��ҵ����C�Ĺ�������һ����ӦΪF������������B��![]() ��д���ò���Ӧ�Ļ�ѧ����ʽ��________________________________��
��д���ò���Ӧ�Ļ�ѧ����ʽ��________________________________��
���𰸡�NO2 HNO3 NH4NO3 NH3 NH3+HNO3=NH4NO3 ������ 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
��������
F��ʹʪ��ĺ�ɫʯ����ֽ���������壬��FΪNH3���ɢ�![]() ��DӦΪ��Σ���E��Ҳ���е�Ԫ�أ���EΪNaNO3����DΪNH4NO3���ɢ�
��DӦΪ��Σ���E��Ҳ���е�Ԫ�أ���EΪNaNO3����DΪNH4NO3���ɢ�![]() ��CӦΪHNO3��A�� B������β������Ҫ�ɷ֣���A��B�ֱ�ΪNO2��NO��
��CӦΪHNO3��A�� B������β������Ҫ�ɷ֣���A��B�ֱ�ΪNO2��NO��
������Ӧ����ʽ�ֱ�Ϊ����![]() ����
����![]() ����
����![]() ��
��
(1)�����Ϸ�����֪��A��C��D��F�ֱ�Ϊ��NO2��HNO3��NH4NO3��NH3��
(2)�ڵĻ�ѧ����ʽΪ��![]() ����Ӧǰ��û�л��ϼ۱仯���ʲ�����������ԭ��Ӧ��
����Ӧǰ��û�л��ϼ۱仯���ʲ�����������ԭ��Ӧ��
(3)F��NH3��BΪNO��������������������NO��H2O����Ӧ����ʽΪ��4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.14.0gFe����������ʴ����Fe2O3��xH2O���缫��Ӧת�Ƶĵ�����Ϊ0.5NA
B.��״���£�11.2LSO2����ˮ����Һ�к������ӵ���Ŀ����0.5NA
C.�����£�0.5LpH=14��Ba(OH)2��Һ��Ba2+����ĿΪ0.5NA
D.����ʽΪC2H6O��ij���л���4.6g������C��H������Ŀһ��Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪±�������Ժ��Ʒ�����Ӧ���������������Ʒ�����ӦΪ��2CH3CH2Br��2Na��CH3CH2CH2CH3��2NaBr��Ӧ����һ��Ӧ�����������������п������ƺϳɻ��������
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʼ䷢����Ӧ�����ĵ����ʵ������ᣬ��������������
A. ľ̿��Ũ����B. ͭ��ϡ����C. п��ϡ����D. ľ̿��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mLһ��Ũ�ȵ���������Һ�У���μ���0.1mol��L-1�İ�ˮ����Ӧ������-1gc(Ag+)��-1gc[Ag(NH3)2+]����백ˮ����Ĺ�ϵ��ͼ������˵��������ǣ� ��
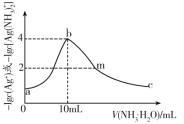
A.ԭ��������Һ��Ũ����0.1mol��L-1
B.��Ӧ��������������Ksp(AgOH)��������Ϊ10-8
C.��Һb��NH4+��Ũ��С����Һc��NH4+��Ũ��
D.��Һm��c(NO3-)>c(Ag+)+c[Ag(NH3)2+]+c(NH4+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(LiMn2O4)�������Ƶõľ�����ά�����ͨ�����������ϡ���MnSO4��LiFePO4Ϊԭ���Ʊ�����﮵�������ͼ��
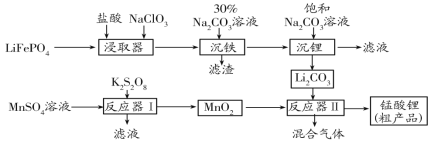
��ش��������⣺
��1����������������������Ϊ��ɫ���壬����Ҫ�ɷ���___��
��2��K2S2O8��S�Ļ��ϼ�Ϊ+6�ۣ���S2O82-�к�����������ĿΪ__����Ӧ�����з�����Ӧ�����ӷ���ʽ__��
��3����Ӧ�����з�Ӧ�¶�Ϊ600��750�档���µ�515��ʱ����ʼ��CO2��������̼��﮵ķֽ��¶�(723��)�͵ö࣬���ܵ�ԭ����___��
��4���Ƶõ�����﮴ֲ�Ʒ�л���LiMnO2��д���ڸ��������·�Ӧ����LiMnO2�Ļ�ѧ����ʽ___����ȡһ����������﮴ֲ�Ʒ����ƿ�У�����ϡ�������ܽ⣬���뺬0.14molNa2C2O4�ı���Һʱǡ����ȫ��Ӧ��ͬʱ����0.19molMn2+��������﮴ֲ�Ʒ��LiMn2O4���ʵ�������Ϊ___�� (MnO2-��Mn2O4-����ΪMn2+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�������̶����ܱ������н��У�N2��g��+3H2��g��![]() 2NH3��g���������й�˵��������ǣ� ��
2NH3��g���������й�˵��������ǣ� ��
A.��ƽ��ʱ��λʱ�����������������ʵ��������ɰ��������ʵ�����ͬ
B.ʹ�ô������Լӿ췴Ӧ���ʣ����̴�ƽ��ʱ��
C.Ϊ�����������ת���ʣ������ʵ����䵪��
D.��ƽ��ʱ���ܱ������е�����������ʵ�������ʼʱ�������ʵ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.̼Ԫ�ع㷺��������Ȼ���У����������������������Ҫ���塣��̼�������ڹ�ҵ���������������й㷺��Ӧ�á�
��1��д����̬̼ԭ�ӵĵ����Ų�ʽ________________�� CO2��_______���ӣ����������������Ǽ�������������̼ԭ�Ӳ�ȡ���ӻ�������_____________��
��2��̼����ͬ����Ԫ�أ�������˵�����߷ǽ��������ǿ������_________�����ţ���
a.CH4���ȶ��Ա�SiH4ǿ b.SiH4�ķе��CH4��
c.̼������Դ��ڹ��� d.SiO2+Na2CO3 =Na2SiO3+CO2��
II.�����裨Si3N4����һ����Ҫ���մɲ��ϣ�����ʯӢ�뽹̿��800�����������ºϳɣ�3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
��1���÷�Ӧ��ƽ�ⳣ������ʽK=__________________����֪ƽ�ⳣ����K(800��)>K(850��)��������Ӧ��__________��Ӧ������������������������
��2����д��������߶�������ת���ʵĴ�ʩ______________��______________��
��3��Mg�ڿ�����ȼ�տ�����������þ��Mg3N2����Mg3N2����������ϡ����ɵõ��������Σ�д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________________________��
��4��������һ�ְ뵼����ϣ��侧������ͼ��ʾ��д�������Ļ�ѧʽ______________��In����λ������֮���������ԭ����Ŀ��Ϊ_______________��
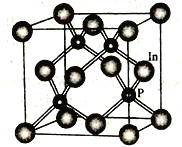
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж���������Ԫ��R��X��Y��Z�������ǵ�������������n��ʾ�����У�n(X)��n(Y)��n(Z)��n(X)��n(Z)��n(R)��������Ԫ�����һ�ֻ�����Q��Q�����������ʣ�
����˵���������
A.ԭ�Ӱ뾶��Y��Z��XB.����������Ӧˮ�������ԣ�Y��Z
C.X��Y��ɵĻ������ڳ����¶�����̬D.Y3Z4�ǹ��ۻ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com