
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数,下列说法正确的是
A.0.5 mol Al与足量盐酸反应转移电子数为1 NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C.0.1 mol CH4所含的电子数为1 NA
D.46 g NO2和N2O4的混合物含有的分子数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
向含大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
A.K+、Br-、CO B.Al3+、H+、MnO
B.Al3+、H+、MnO
C.NH 、Fe3+、SO
、Fe3+、SO D.Ag+、Cu2+、NO
D.Ag+、Cu2+、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
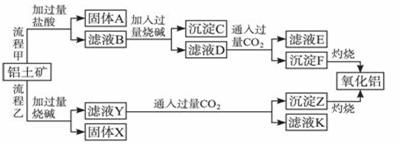
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液D产生沉淀F的离子方程式为______________________________。
(5)滤液E、K中溶质的主要成分是____(填化学式),写出该溶质的一种用途_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如右图:则C4Si4H8的二氯代物的同分异构体数目为( )
A.6 B.5 C.4 D.3
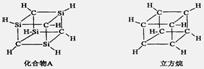
查看答案和解析>>
科目:高中化学 来源: 题型:
金银花是治疗和预防甲型H1N1的常见中草药,有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构式见右图,下列有关绿原酸的说法不正确的是( )
A.分子式为C16H18O9
B.1mol绿原酸与溴水反应最多消耗4molBr2
C.1mol绿原酸最多与5molH2加成
D.1mol绿原酸最多与4molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1 = 571.2
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,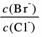 = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)  2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
⑴ 比较下列两组物质的熔点高低(填>或<)
SiC______ Si; SiCl4 ______ SiO2
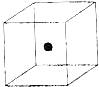
⑵ 图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) + 4HCl(g)
Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)则原溶液中肯定存在的离子是________________________,肯定不存在的离子是___________________________,依次写出步骤②中所发生反应的离子方程式______________________________________________________________________________;
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?______(填“有”或“无”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com