
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑.
;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑.分析 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素,结合对应单质、化合物的性质以及元素周期率的递变规律以及题目要求解答该题.
解答 解:X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素.
(1)Y为O元素,在元素周期表中的位置为:第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,S元素非金属性最弱,非金属气态氢化物还原性最强的是H2S,
故答案为:HClO4;H2S;
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:Cl2、O3、ClO2等
故答案为:Cl2、O3、ClO2等;
(4)Z是Na,Y是O,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,与水反应生成氢氧化钠和氧气,反应的离子方程式为 Na2O2+2H2O=4Na++4OH-+O2↑,
,与水反应生成氢氧化钠和氧气,反应的离子方程式为 Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为: ; Na2O2+2H2O=4Na++4OH-+O2↑;
; Na2O2+2H2O=4Na++4OH-+O2↑;
(5)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2 Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe,
Fe+2NaCl,放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为Fe2++2e-=Fe,
故答案为:Fe2++2e-=Fe.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意把握原子结构和元素周期率的关系,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na$\stackrel{o_{2}/常温}{→}$Na2O2$\stackrel{水}{→}$NaOH | B. | HCl(浓)$→_{△}^{MnO_{3}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | ||
| C. | Si$\stackrel{O_{2}}{→}$SiO2$\stackrel{水}{→}$H2SiO3 | D. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)| 制取的气体 | 药品 | 化学方程式 |
| O2 | H2O2MnO2 | 2H2O2═2H2O+O2↑ |
| H2 | 某溶液、Al | 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ |
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
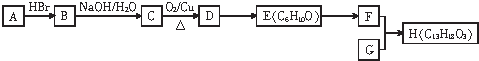
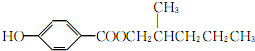
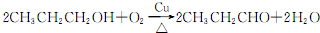
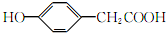 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
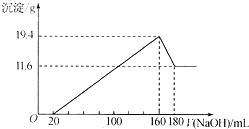 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
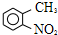 路线如下:
路线如下: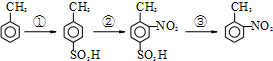 (反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.
(反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.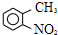 互为同分异构体,并同时满足下列条件的有机物有
互为同分异构体,并同时满足下列条件的有机物有 (写结构简式).
(写结构简式).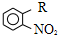 为原料,制取
为原料,制取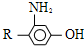 ,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e.
,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e. 合成
合成 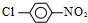 的化学方程式
的化学方程式 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,
+HCl, $→_{△}^{浓硝酸、浓硫酸}$
$→_{△}^{浓硝酸、浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可以使溴水褪色是因为它有漂白性 | |
| B. | 浓硫酸可用于干燥H2S和CO2 | |
| C. | 可以用加热法除去NaCl固体中的混有的NH4Cl | |
| D. | 过量的Cu与浓硝酸反应不可能有一氧化氮生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com