
����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣨1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ������������
��ѧ�� | Si��O | O�TO | Si��Si |
����/kJmol��1 | x | 498.8 | 176 |
��1����֪1mol Si�к�2mol Si��Si����1mol SiO2�к�4mol Si��O������x��ֵΪ
��2���������Ϊ��Դ�ѹ㷺Ӧ�����������ǡ���������������վ�ȣ��������һ�ְ� ��ת��Ϊ �ܵ�װ�ã�
��3���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ������ĸ����
A����������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B�������Դ�ḻ�����ڿ��ɣ��ҿ�����
C����ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D��Ѱ�Ҹ�Ч�´�����ʹ����������ܺܵͣ��ǹ���Դ�������õĹؼ�����
��4����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ�÷�Ӧ����Ӧ������ ������ա����ͷš���������Ϊ kJ��
���𰸡�
��1��460
��2���⣻��
��3��D
��4�����գ�6.01
���������⣺��1����֪������ȼ����Ϊ989.2kJmol��1 �� ��Si��s��+O2��g��=SiO2��s����H=��989.2kJmol��1��1mol������к���2molSi��Si��1molSiO2�к���4molSi��O��1molO2�к���1molO=O����2��176+498.8��4x=��989.2�����x=460�����Դ��ǣ�460����2������ؽ�̫����ת��Ϊ���ܣ�̫������ˮ���ǽ�̫����ת��Ϊ���ܣ����Դ��ǣ��⣻�磻��3��A���賣����Ϊ���壬���ʽ��ȶ����������棬��Ϊ��ȫ����A��ȷ��
B��������Ȼ���к����ḻ��������������B��ȷ��
C������Ϊһ���ձ�ʹ�õ�������Դ����������˵��ȼ�շų���������ȼ�����ɶ������裬���������ǹ��壬��������Ч���ƣ���C��ȷ��
D������ֻ�ܼӿ컯ѧ��Ӧ�����ʣ����ı䷴Ӧ�ȣ���D����
���Դ��ǣ�D����4��ͨ��100mL 1molL��1��NaOH��Һǡ�÷�Ӧ˵�����ɵ��Ȼ���Ϊ0.1mol���跴Ӧ���յ�����Ϊx��
2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1
4 240.4
0.1 x ![]() =
= ![]() �����x=6.01kJ��
�����x=6.01kJ��
���Դ��ǣ����գ�6.01��
�����㾫����������Ŀ����֪�������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij100mL�����Һ�У��������������ʵ���Ũ�ȷֱ�Ϊ0.4mol/L��0.1mol/L����û����Һ�м���1.92��ͭ�ۣ����ȴ���ַ�Ӧ��������Һ�е�Cu2+�����ʵ���Ũ����________________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У����ڷ��Է����̵��ǣ� ��
A.N2��O2���
B.���¡���ѹ�£�ʯīת��Ϊ���ʯ
C.H2��O2��������H2O
D.C+O2 ![]() CO2
CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��
KIO3+ KI+ H2SO4�T K2SO4+ I2 + H2O
��1����ƽ�÷���ʽ��������˫���ŷ���ʾ�÷���ʽ����ת�Ƶķ�������Ŀ��____________________
��2���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��3�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼס��ҡ���������ͬ�ܱ������а���ͬ��ʽͶ�ϣ�һ�������·�����Ӧ(��ʼ�¶Ⱥ���ʼ�����ͬ):N2(g)+3H2(g)![]() 2NH3(g) ��H<0������������±���ʾ:
2NH3(g) ��H<0������������±���ʾ:
���� | �� | �� | �� |
������� | ���º��� | ���Ⱥ��� | ���º�ѹ |
��Ӧ��Ͷ�� | lmolN2��3molH2 | 2molNH3 | 2molNH3 |
ƽ��ʱ������� | V�� | V�� | V�� |
��Ӧ��ƽ�ⳣ��K | K�� | K�� | K�� |
ƽ��ʱNH3��Ũ��/mol/L | c�� | c�� | c�� |
ƽ��ʱNH3�ķ�Ӧ����/mol/(L��min) | v�� | v�� | v�� |
����˵����ȷ����
A. V��>V�� B. K��>K�� C. c��>c�� D. V��=V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO4��Һ��pH��ǰ�ߵ�PH�Ⱥ��ߵĴ� | Ԫ�طǽ�������S>C |
B | ��ʢ��Fe(NO3)2��Һ���Թ��м���0.lmol.L-1H2SO4��Һ���Թܿڳ��ֺ���ɫ���� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
C | ��FeBr2��Һ�м���������ˮ���ټ�CCl4��ȡ��CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
D | ����Һ�еμ������ữ��BaC12��Һ��������ɫ���� | ��Һ��һ������SO42- |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����˾��зḻ��Ӫ������������������붹������ͬʱʳ�á�
���ϣ���1�������к��п����Բ����Ρ�̼���ε�
��2����������Ʒ�Ӧ
��3��ij����ƾ��壨CaC2O4��xH2O������Է�������Ϊ128+18x
��ʵ��һ�������в��ֳɷַ���

��1���ÿ�ˮ��в�����Ʒ��ĩ2~3 min��Ŀ����___________________��
��2����ҺM�к��е���Ҫ��������____________________��
��3����֪C��ʹ����ʯ��ˮ����ǡ�A���������C�Ļ�ѧ����ʽ��__________��
��4��B�Ļ�ѧʽ������________________��
��5�������̼�������___________���ǿ������������
��ʵ�������ij����ƾ�������ȷֽ��о����õ����������ͼ��ʾ��

��1��800��ʱ�õ��Ĺ���ֻ����Ԫ�غ���Ԫ�أ�������Ϊ5:2���仯ѧʽ��__________��
��2������������12.8 g��Ϊ10.0 g�Ĺ����з�����Ӧ�Ļ�ѧ����ʽ��__________��
��3��x =_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£��ش��������⣺
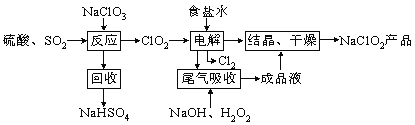
��1��ClO2�ķе�Ϊ283K����ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10%���¸���ȫ��д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
��2����β��������������������������ų�������ClO2��
����β�����չ����У��ɴ���H2O2���Լ��� �����������
A��Na2O2 B��Na2S C��FeCl2 D��KMnO4
�����β��������Ч�ʵĿ��д�ʩ�� �����������
A��β������ʱ��ֽ�������Һ B���ʵ��ӿ�β����ͨ������
C�����¶ȿ�����20������ D����ˮϡ��β������Һ
�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڼ�����Һ��NaClO2�Ƚ��ȶ�����������Һ�У�ClO2-��H+���ΪHClO2��HClO2��Ψһ����±�ᣬ���ȶ����ֽ����Cl2��ClO2��H2O��д��HClO2�ֽ�Ļ�ѧ����ʽ�� ��
��4����֪NaClO2���ܽ�����¶����߶�����NaClO2������Һ��38������60�����»�����NaClO2����NaClO2���������п��ܻ��е������� ���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ�������������Ҫ���壬��ش��������⣺
��1��һ�������£���һ���������ܱ������г���2mol SO2��1mol O2������Ӧ��������˵����ȷ���� ��
A.����Ӧ����v��SO2����v��SO3���������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B.�����¶Ⱥ�����������䣬����2mol N2 �� ��ѧ��Ӧ���ʼӿ�
C.ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D.ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
E.�����¶Ⱥ�����������䣬ƽ����ٳ���2mol SO3 �� �ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
F.ƽ��������¶ȣ�ƽ�ⳣ��K����
��2����ij�¶��£�SO2��g��+ ![]() O2��g��SO3��g����H=��98kJ/mol����ʼʱ��100L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=���÷�����ʾ�����ڸ��¶��£��ֱ�0.2mol/L ��SO2 ��0.1mol/L O2����̶�������ܱ������У���SO2ת����Ϊ60%ʱ���÷�Ӧ���������
O2��g��SO3��g����H=��98kJ/mol����ʼʱ��100L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=���÷�����ʾ�����ڸ��¶��£��ֱ�0.2mol/L ��SO2 ��0.1mol/L O2����̶�������ܱ������У���SO2ת����Ϊ60%ʱ���÷�Ӧ���������
��3����һ��2L���ܱ������г���һ������SO3������Ӧ������SO3�ı仯����ͼ��ʾ����10 min��ѹ������Ϊ1L����SO3�ı仯����Ϊ����ͼ���е���ĸ��ţ���
��4����ӦN2O4��g��2NO2��g������H=+57kJmol��1 �� ���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����
A.A��C����ķ�Ӧ���ʣ�A��C
B.A��C�����������ɫ��A�Cdz
C.��״̬B��״̬A�������ü��ȵķ���
D.��P2��P1 �� ��ѧƽ�ⳣ��KA��KC
��5����CH4����ԭNOxҲ�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=��574KJ/mol
��CH4��g��+4NO ��g��=2N2��g��+CO2��g��+2H2O��g����H2=��1160KJ/mol
��д��1molCH4��ԭNO2����N2��CO2��H2O��̬���ʵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com