
【题目】在某100mL混合溶液中,硝酸和硫酸的物质的量浓度分别为0.4mol/L和0.1mol/L,向该混合溶液中加入1.92克铜粉,加热待充分反应后,所得溶液中的Cu2+的物质的量浓度是________________ mol/L。
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)N204(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 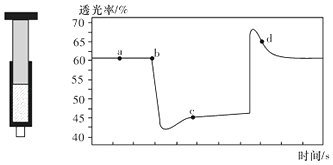
A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃的纯水中通入一定量的氯化氢,当溶液的pH=1时,则由水电离出的c(H+)是( )
A.1×10﹣1mol/L
B.1×10﹣6mol/L
C.1×10﹣3mol/L
D.1×10﹣13mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
![]()
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途_______;
(2)若A为淡黄色固体单质,写出D的浓溶液与铜反应的化学方程式______;
(3)若A是化合物,C是红棕色气体,则A的化学式为_____________;C转化为D的过程中,氧化剂与还原剂的质量比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示。下列分析错误的是( )
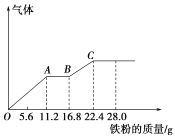
A. AB段的反应为Fe+2Fe3+===3Fe2+
B. 第二份溶液中最终溶质为FeSO4
C. 混合酸中NO![]() 物质的量为0.4 mol
物质的量为0.4 mol
D. 混合酸中H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A 是一种重要的光化学试剂,属不含结晶水的盐.A~I 之间相互转化关系如下图所示: (部分反应物、生成物没有列出)

已知: A 中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且相对分子质量是C 的2倍。C、D 都为气体且含有元素种类相同,C 能使澄清石灰水变浑浊,E 是一种红棕色的颜料,F 的焰色反应呈紫色,I能使KSCN 溶液显红色。回答下列问题:
(1)A 的化学式________。
(2)①方程式________。
(3)D+E→C+G 的方程式________。
(4) H+H2O2+ H+→I 的离子反应方程式________。
(5)在A 的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去;而在A 的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)═SiO2(s)△H=﹣989.2kJmol﹣1 , 有关键能数据如表:
化学键 | Si﹣O | O═O | Si﹣Si |
键能/kJmol﹣1 | x | 498.8 | 176 |
(1)已知1mol Si中含2mol Si﹣Si键,1mol SiO2中含4mol Si﹣O键,则x的值为
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等.硅光电池是一种把 能转化为 能的装置.
(3)假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是 (填字母).
A、硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B、硅的来源丰富,易于开采,且可再生
C、硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D、寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)═Si(s)+4HCl(g)△H=+240.4kJmol﹣1 , 生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应,则反应过程中 (填“吸收”或“释放”)的热量为 kJ.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com