
【题目】细胞鲜重中含量最多的元素和组成生物体的最基本元素,分别是
A.O、CB.H、CC.C、OD.O、N
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列问题:
I.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435mL。同学们发现实验室内没有450mL的容量瓶,某同学提议用1个200mL容量瓶和1个250mL容量瓶来配制,你认为该提议______(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250mL,则需量取密度为1.84g/mL、98%的浓硫酸________mL(结果保留小数点后一位)。
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。 某实验小组利用如下装置对该实验进行改进。回答下列问题:

注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(3)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是 SO2,
①、②、③处发生的变化分别说明SO2具有_______、________和__________(填SO2表现出的性质)。
(4)SO2和Cl2均可以使品红溶液褪色,但将两种气体按体积比1:1混合通入品红溶液中,品红溶液不褪色,其原因是___________(用化学方程式回答)。
(5)打开活塞K, a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位罝的滤纸滴加_______溶液,该试剂的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)4C(g)+6D(g) 在5L的密闭容器中进行反应,30min后,C的物质的量增加了0.30mol.下列叙述正确的是( )
A.30min中A的平均反应速率是0.010molL﹣1min﹣1
B.容器中D的物质的量一定增加了0.45mol
C.容器中A,B,C,D的物质的量的比一定是4:5:4:6
D.容器中A的物质的量一定增加0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合溶液中,硝酸和硫酸的物质的量浓度分别为0.4mol/L和0.1mol/L,向该混合溶液中加入1.92克铜粉,加热待充分反应后,所得溶液中的Cu2+的物质的量浓度是________________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)
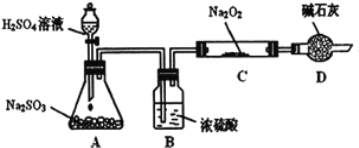
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:________________。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_______。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。
假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
![]()
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5gNaHCO3、Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是
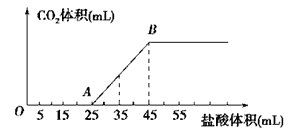
A. OA段发生反应的离子方程式为:OH-+H+==H2O H++CO32-==HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为336mL
C. 混合物中NaOH的质量0.6g
D. A点溶液中的溶质为NaCl、NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:
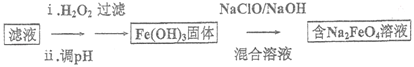
①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH,前者的PH比后者的大 | 元素非金属性:S>C |
B | 向盛有Fe(NO3)2溶液的试管中加入0.lmol.L-1H2SO4溶液,试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
D | 向溶液中滴加盐酸酸化的BaC12溶液,产生白色沉淀 | 溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com