
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。

(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
【答案】a C B C2H5OH![]() C2H4↑+H2O 2C2H5OH
C2H4↑+H2O 2C2H5OH![]() C2H5OC2H5+H2O 2HBr+H2SO4(浓)
C2H5OC2H5+H2O 2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O
Br2+SO2↑+2H2O
C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O
2C+2SO2↑+5H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(任意选取 3 个反应即可) 将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
CO2↑+2SO2↑+2H2O(任意选取 3 个反应即可) 将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
【解析】
(1)由题给信息,知该反应为:C2H5-OH+HBr![]() C2H5Br+H2O,反应需要加热,所以应采用装置a;
C2H5Br+H2O,反应需要加热,所以应采用装置a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的,V(C2H5OH)=![]() =14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,故答案为C;
=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,故答案为C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出,故答案为B;
(4)可能发生的副反应有:C2H5OH脱水生成乙烯和乙醚;浓H2SO4氧化HBr;C2H5OH脱水炭化等反应.故答案为:C2H5OH![]() C2H4↑+H2O、2C2H5OH
C2H4↑+H2O、2C2H5OH![]() C2H5OC2H5+H2O、2HBr+H2SO4(浓)
C2H5OC2H5+H2O、2HBr+H2SO4(浓)![]() Br2+SO2↑+2H2O、C2H5OH+2H2SO4(浓)
Br2+SO2↑+2H2O、C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O、C+2H2SO4(浓)
2C+2SO2↑+5H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(任意选取2个反应即可);
CO2↑+2SO2↑+2H2O(任意选取2个反应即可);
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用质量分数小于5%的稀NaOH溶液洗涤除去,采用稀NaOH溶液,是为了防止C2H5Br的水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题:
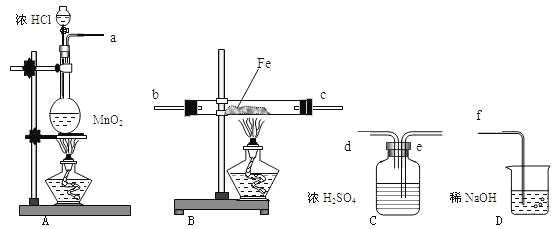
(1)实验时,各装置接口的连接顺序为___________________________(用a、b、c、d等字母表示);
(2)C装置的作用是________________________;
(3)D装置的作用是_____________________________________;
(4)检验B装置中反应后铁是否有剩余的方法是:_______________________;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,________(答:是或否);说明理由:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿比朵尔具有很好的抗病毒活性,其合成路线如下:
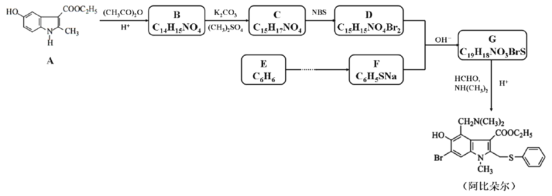
已知:①![]() +HCHO+
+HCHO+
![]()

②RX![]() RLiX
RLiX![]() RSH
RSH
请回答:
(1)下列说法正确的是___________。
A.化合物A能发生加成、取代和氧化反应,不发生还原反应
B.化合物B具有弱碱性
C.化合物D与FeCl3溶液发生显色反应
D.阿比朵尔的分子式是C22H25N2O3BrS
(2)写出化合物D的结构简式___________。
(3)写出G→阿比朵尔的化学方程式___________。
(4)设计从E→F的合成路线(用流程图表示,无机试剂任选)___________。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式___________。
①1H-NMR谱和IR谱检测表明:分子中共有4种氢原子,含氮氧单键和碳氧双键;
②含有苯环和含氮五元杂环,且两环共棱连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式____________________。Cu放入0.1 mol/L FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4∶3,则反应后溶液中Cu2+与Fe3+的物质的量之比为(______)
A.3∶2 B.3∶8 C.4∶3 D.3∶4
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是________(填字母序号)。
A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可
B.在FeCl3溶液中加入足量的NaOH溶液
C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为____________________________________。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+2KI===2FeCl2+I2+2KI在上式中用双线桥法标出该反应电子转移的方向和数目__________________。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 ________色,再将混合液倒入________(填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
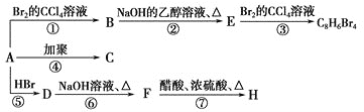
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置探究浓硫酸与铜是否发生反应及反应所产生气体的性质。请回答下列问题:
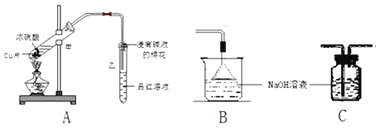
(1)写出试管甲中所发生反应的化学反应方式___。
(2)通过试管甲中溶液变为___色,乙中品红溶液___等现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有___性。
(3)SO2的排放是造成酸雨的主要因素,为了减少SO2的排放,常用石灰(CaO)法对煤燃烧后的烟气脱硫,其原理是___(用化学方程式表示 )。
(4)SO2在适当的温度并有一定催化剂存在的条件下可以转化为SO3,其化学反应方程式为__。
(5)为防止二氧化硫造成空气污染,如果需要在装置末端增加尾气吸收装置,应选择的装置是__(填“B”或“C”)。
(6)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
①在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。(______)
②Na2CO3与H2SO4反应,可生成Na2SO4和CO2。(______)
③向滤纸上滴加浓H2SO4 ,滤纸变黑。(______)
④在冷浓H2SO4中放入铁片没明显现象。(______)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com