
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
A.两种物质的阴离子半径都比阳离子半径小
B.与水反应时,水都作氧化剂
C.与盐酸反应都只生成一种盐
D.溶于水,所得溶液都能使无色酚酞变红
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知氧化性:Br2>Fe3+>I2;还原性:I﹣>Fe2+>Br﹣,则下列反应能发生的是( )
|
| A. | I2+2Fe2+═2Fe3++2I﹣ | B. | 2Br﹣+I2═Br2+2I﹣ |
|
| C. | 2Fe3++2I﹣═2Fe2++I2 | D. | 2Fe3++2Br﹣═2Fe2++Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l) Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
①②④ B.①③⑤ C.③⑤⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香烃X是一种重要的化工原料,其相对分子质量为92,现以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,F的分子式为C7H7NO2,Y是一种功能高分子材料。
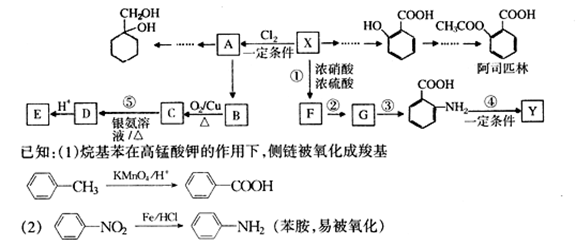
请根据本题所给信息与所学知识回答下列问题:
(1) X→A “一定条件”是指的何种条件__ ___ ,反应③的条件
(2)写出反应类型:反应① ,反应② 。
(3)阿司匹林与足量NaOH溶液反应的化学方程式 。
(4)Y的结构简式为 。
(5)以下是由A和其他物质合成 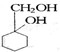 的流程图:
的流程图:
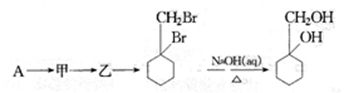
完成甲→乙的化学反应方程式: 。
(6)
比  多一个碳原子的同系物M有多种同分异构体, 同时符合下列4个条件的M同分异构体有 种
多一个碳原子的同系物M有多种同分异构体, 同时符合下列4个条件的M同分异构体有 种
①分子中含有苯环;
②能发生水解反应;
③在苯环上只能生成2种一氯取代物.
④常温下不与NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
由Na2O2、Na2CO3、NaHCO3、Na2O、NaCl中的某几种组成的混合物,向其中加入足量的盐酸,有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出且固体质量增加。下列判断正确的是( )
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3、Na2O
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4 + 16HCl(浓) =" 2KCl" + 5Cl2↑ + 2MnCl2 + 8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)
A.1mol/L B.2mol/L C.4mol/L D.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2SO2+O2 2SO3的平衡状态下,保持恒温恒容,向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)
2SO3的平衡状态下,保持恒温恒容,向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)
A.Qc不变,K变大,O2转化率增大 B. Qc不变,K变大,SO2转化率减小
C. Qc变小,K不变,O2转化率减小 D. Qc增大,K不变,SO2转化率增大
示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com