
【题目】下列说法正确的是
A. 花生油和玉米油都是可皂化的饱和酯类
B. 溴苯、硝基苯和环已烷都难溶于水且密度都大于水
C. 分子式为C10H14的单取代芳香烃,其可能的结构有4种
D. 尼龙、涤纶和有机玻璃都是通过缩聚反应制得的
【答案】C
【解析】分析:A项,油脂都能发生皂化反应,动物脂肪主要成分为饱和酯,植物油主要成分多为不饱和酯;B项,一般硝基化合物密度大于水,很多卤代烃密度也是大于水的,烃类物质密度一般都小于水;C项,分子式为C10H14的单取代芳香烃,不饱和度为4,分子中含有一个苯环和一个丁基,其同分异构体取决于丁基的种数;D项,尼龙属于聚酰胺纤维,涤纶属于聚脂纤维,聚甲基丙烯酸甲酯(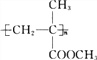 )又称有机玻璃。
)又称有机玻璃。
详解:A项,花生油和玉米油都属于植物油,植物油多为不饱和酯类,故A错误;B项,溴苯、硝基苯都难溶于水且密度都大于水,环已烷难溶于水且密度比水的小,故B错误;C项,分子式为C10H14的单取代芳香烃,侧链为丁基(-C4H9),因为丁基有四种,所以分子式为C10H14的单取代芳香烃,其可能的结构有4种,故C正确;D项,尼龙和涤纶都是通过缩聚反应制得的,有机玻璃(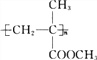 )是通过加聚反应制得的,故D错误。综上分析,符合题意的选项为C。
)是通过加聚反应制得的,故D错误。综上分析,符合题意的选项为C。


科目:高中化学 来源: 题型:
【题目】硒是制造光电池的一种原料,人体缺少硒就会得“克山病”。从电解精炼铜的阳极泥中提取硒的流程如下,已知阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在:

请回答下列问题:
(1)电解精炼铜时,粗铜与电源的_____(填“正极”或“负极”)相连。
(2)SeO2溶于水得到H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),常温下亚硒酸溶液与少量氢氧化钠溶液反应的离子方程式为:_________________,反应所得的盐形成的溶液pH____7,(填>、<或=)原因是________________________________(用相关数据及必要的文字说明)
(3)亚硒酸溶液与SO2反应制硒的化学方程式为_____________________________。电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阴极反应式为________________。
(4)上述硒的提取过程中除了焙烧过程中浓硫酸有强烈的腐蚀性外,还存在的主要问题是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
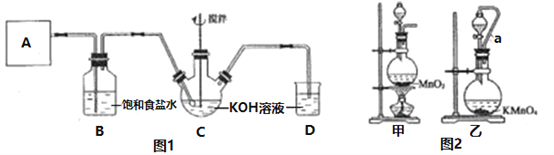
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蛋白质含有C、H、O、N等元素。下列关于自然界中氮循环的说法错误的是
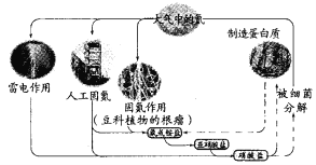
A. 含氮无机物和含氮有机物可相互转化
B. 碳、氢、氧三种元素也可能参与了氮循环
C. 铵盐转化为硝酸盐,发生了还原反应
D. 目前人工固氮的反应为N2+3H2![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应:A2(g)+3 B2(g)![]() 2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g) (每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
A.Q2 = 2 Q1 B.2Q1 < Q2
C.Q1 < Q2 < 92.4 kJ D.Q1 = Q2 < 92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川师范大学化学与材料学院对“铁与水蒸气反应”实验研究的结果显示:在80~100℃能产生稳定水蒸气的物质都可以作为该反应的供水剂;铁与水蒸气反应温度在500℃左右即可顺利进行。
某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是_______________。
(2)C中碱石灰的作用是______________。
(3)D处实验现象为___________________________。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

①加入稀硫酸发生的离子方程式为______________________________。
②试剂A是_____________(选填字母),现象2为___________________。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为_____(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
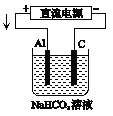
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
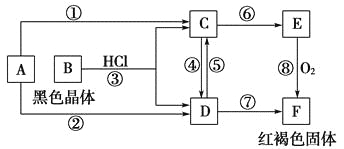
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________。
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com