
【题目】(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
【答案】(1)①减少高铁酸钾的溶解损失(2分)
②3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(2分)
③高铁酸钾(K2FeO4)有强氧化性 (1分)高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性(有絮凝作用),使水澄清起净水作用 (1分) ④3 (2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(1分) ②小 (1分)
(3)3:1 (2分)(4)2FeO42-+6e-+8SO3![]() 2Fe3++8SO42-(2分)
2Fe3++8SO42-(2分)
【解析】试题分析:(14分)
(1)①为防止K2FeO4的溶解,可用异丙醇洗涤,所以答案是减少高铁酸钾的溶解损失。
②ClO-在碱性条件下可将Fe3+氧化为FeO42-,据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,反应II的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O。
③ 高铁酸钾(K2FeO4)在水中能消毒杀菌是因为有强氧化性,净水的原因是高铁酸钾的还原产物水解产生的Fe(OH)3胶体,有吸附性,使水澄清起净水作用。
④Ksp =c(Fe3+)·c3(OH-)= 4.0×10-38,所以=![]() ,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
,c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH= 3;
(2)①加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出;
②溶解度小的沉淀先析出来,所以高铁酸钾的溶解度比高铁酸钠;
(3)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,
2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,
(4)高铁酸钾得电子,做氧化剂,所以在正极反应的是FeO42-,电极反应式:2FeO42-+6e-+8SO3![]() 2Fe3++8SO42-。
2Fe3++8SO42-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.高铁酸钾( K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F="96500" C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。

(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH﹣═H2O表示的反应是( )
A.稀醋酸和稀氨水反应
B.稀硫酸和烧碱溶液反应
C.稀盐酸和氢氧化铜反应
D.稀硫酸和氢氧化钡溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的 A.CH3COONa、B.NaCN、C.Na2CO3、D.NaHCO3溶液的pH由大到小的顺序为____________(填字母)。
(2)常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)·C(OH-)
(3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是____________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”)

(4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=__________mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_________。
(5)用离子方程式表示Na2CO3溶液呈碱性的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法错误的是
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 30℃甲苯与浓硫酸浓硝酸混合,反应的主要产物为邻硝基甲苯和对硝基甲苯
C. 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D. 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
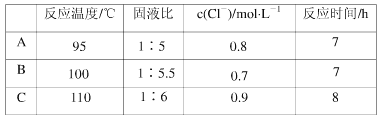
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成a molCu,共消耗________ mol O2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com