
【题目】下图是第三周期11![]() 17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )
17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )

A. y轴表示的可能是电离能 B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径 D. y轴表示的可能是形成基态离子转移的电子数
【答案】B
【解析】分析:本题考查元素周期律同一周期自左向右元素性质的递变规律,涉及电离能、电负性、原子半径和形成基态离子转移的电子数。
详解:A、同一周期内元素的第一电离能在总体增大的趋势中有些趋势。当外围电子在能量相等的轨道上形成全空(p0,d0,f0)、半满(p3,d5,f7)或全满(p6,d10,f14)结构时,原子的能量较低,元素的第一电离能较大,故ⅢA的第一电离能小于ⅡA的电离能,ⅥA的第一电离能小于ⅤA的电离能,故错误;B、同周期元素从左到右,电负性逐渐增大,故B正确;C、同周期元素从左到右,原子序数逐渐增大,原子半径逐渐减小,故C错误;
D、形成基态离子转移的电子数为:钠为1,镁为2,铝为3,硅不易形成离子,磷为3,硫为2,氯为1,故D错误。因此本题答案为B。


科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是
A. 该有机物中C采取sp2杂化
B. 该有机物的一氯代物仅有1种
C. 该有机物的碳原子构成正四面体
D. 该有机物的不饱和度为3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
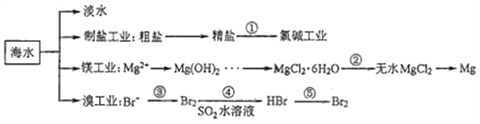
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,中国科学家研发了一种碳修饰的镍基催化剂,实现了木质素选择性氢解得到酚类化合物。请回答下列问题:
(1)基态碳原子的核外电子有____种运动状态, 基态Ni原子的核外电子排布式为_________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为______________________。
(3)图1所示化合物中碳原子的杂化方式为_________,存在的化学键类型有_________(填标号)。

A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(4)碳的氧化物CO常作为许多金属配合物的配体,CO与N2互为等电子体,则CO分子中σ键与π键的个数比为______;测得熔点为170℃,预测属于___________晶体。
(5)一种储氢材料由镍、 镁元素组成,其晶胞结构如图2所示,则该晶体的化学式为__________,其晶胞边长为apm,列式计算晶胞密度为___________g/cm3 (不必计算出结果,阿伏加德岁常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为__________。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与Na2O2的结构和化学性质相似,其溶液显黄色。H的电子式为______。
(3)化学家发现一种化学式为A4B4的化合物,由均带一个电荷的阴、阳离子组成,则该阴、阳离子为_______。
(4)B2A4C3是一种常见的炸药,其在常温下撞击时会生成一种气体(B2C)和一种常见液体,该反应的化学力程式为______________。8g该物质反应转移的电子数目为________。
(5)下列事实能说明元素F的非金属性比元素E的非金属性强的是______。
a.元素F形成的单质比元素E形成的单质的熔点低
b.F和E两元素的简单氢化物受热分解,前者的分解温度高
c.F2通入到D2E的溶液中出现浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
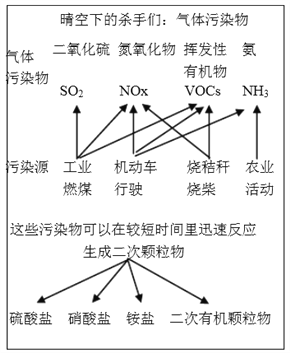
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
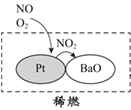
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。
(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:
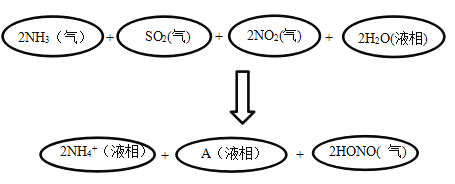
请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com